catalase lab pt - MetabolicEngineeringGroupCBMA/MetabolicEngineeringGroupCBMA.github.io GitHub Wiki
A catalase é uma enzima que catalisa a decomposição do peróxido de hidrogénio em água e oxigénio.
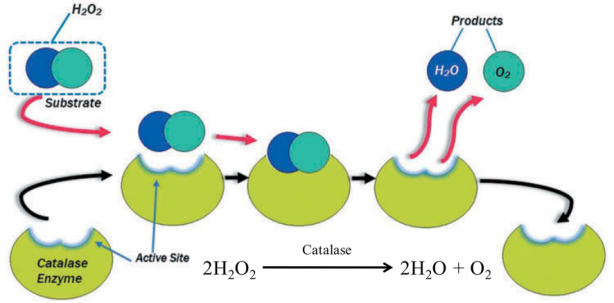
Figura 1
O objetivo desta aula prática é medir a atividade da catalase em células de permeabilizadas de levedura Saccharomyces cerevisiae.
A acil-CoA oxidase é a primeira enzima da via peroxisomal da β-oxidação, responsável por catalisar a oxidação da acil-CoA, um processo que decompõe ácidos gordos.

Figura 2
Ao contrário das mitocôndrias, onde o FADH₂ entra na cadeia transportadora de eletrões, o FADH₂ peroxisomal doa diretamente os seus eletrões ao oxigénio molecular, resultando na formação de peróxido de hidrogénio (H₂O₂). Este passo é único na β-oxidação peroxisomal, já que, nas mitocôndrias, os transportadores de eletrões como o FADH₂ contribuem para a síntese de ATP através da fosforilação oxidativa. Nas peroxissomas, no entanto, o FADH₂ é rapidamente oxidado de volta para FAD, permitindo a oxidação contínua dos ácidos gordos, mas produzindo H₂O₂ como subproduto em vez de ATP.

Figura 3
Os Complexos I e III podem, inadvertidamente, perder eletrões para o oxigénio molecular, formando superóxido. O ânion superóxido (O₂⁻•) gerado nos Complexos I e III da cadeia transportadora de eletrões mitocondrial é desintoxicado principalmente pela enzima superóxido dismutase (SOD).

Figura 4
NOX1 e NOX2 são enzimas que pertencem à família da NADPH oxidase (NOX), desempenhando papéis cruciais na produção de espécies reativas de oxigénio (ROS) como parte da sinalização celular e respostas imunitárias. Ao contrário da geração de ROS mitocondrial, estas enzimas geram ROS diretamente na membrana celular ou em compartimentos celulares específicos.
- Localização: Expressa principalmente em células epiteliais, incluindo as do cólon e em células musculares lisas vasculares.
- Função: A NOX1 gera superóxido (O₂⁻•), que pode ser convertido em outras ROS, como o peróxido de hidrogénio (H₂O₂).
- Papel na função celular: Envolvida na sinalização celular relacionada à proliferação, migração e respostas imunitárias. A NOX1 também está implicada na remodelação vascular, respostas inflamatórias e na progressão de alguns tipos de cancro, onde as ROS desempenham um papel na sinalização do crescimento celular.
- Localização: Conhecida principalmente pelo seu papel em células fagocíticas (como neutrófilos e macrófagos), mas também é expressa noutros tipos de células.
- Função: A NOX2 é crucial para a resposta imunitária, pois produz superóxido em fagossomas para destruir patógenos ingeridos. O superóxido gerado pela NOX2 contribui para a “explosão respiratória”, uma libertação rápida de ROS que mata bactérias e outros patógenos.
- Papel na defesa do hospedeiro: As ROS derivadas da NOX2 são críticas na defesa antimicrobiana. Defeitos hereditários na NOX2 levam a uma capacidade reduzida de combater infeções.

Figura 5
O glutationa (GSH) remove o peróxido de hidrogénio (H₂O₂) através de uma reação enzimática envolvendo a glutationa peroxidase (GPx). Esta enzima catalisa a redução do H₂O₂ em água, utilizando o glutationa como doador de eletrões.
Figura 6
O teste da catalase é um ensaio bioquímico simples utilizado para identificar organismos capazes de produzir a enzima catalase. Todos os microrganismos aeróbicos conhecidos produzem catalase. No teste (Figura 7), uma pequena quantidade de cultura bacteriana é exposta a peróxido de hidrogénio, e a formação de bolhas indica um resultado positivo, significando atividade de catalase. Este teste é frequentemente utilizado para diferenciar entre organismos catalase-positivos, como Staphylococcus spp., e catalase-negativos, como Streptococcus spp. na microbiologia clínica.
O protocolo baseia-se numa combinação de um método para preparar células de levedura permeabilizadas com etanol descrito por Trawczyńska & Wójcik 2015 e um ensaio para peróxido utilizando iões de cobalto descrito por Hadwan 2018.
Após as células serem permeabilizadas, o substrato, como o H2O2, consegue alcançar mais facilmente a enzima catalase, e os produtos (H2O e O2) conseguem sair mais facilmente (Figura 8).
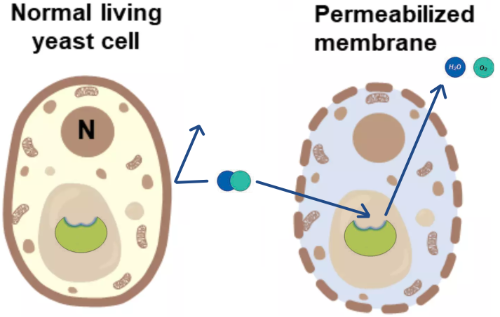
Figura 7
O protocolo de permeabilização é muito simples. As células de levedura são incubadas com etanol durante 20 minutos num tampão de fosfato.
As células permeabilizadas são misturadas com peróxido de hidrogénio e incubadas durante 10 minutos a 37 °C. Durante este tempo, parte do peróxido de hidrogénio é consumido pela catalase e decomposto em oxigénio e água.
O peróxido restante é medido permitindo que este oxide o cobalto(II) para cobalto(III), que pode ser medido com um espectrofotómetro a 440 nm (Figura 9). A oxidação é realizada na presença de iões de carbonato, que formam um complexo rosa com cobalto(II) e um complexo verde com cobalto(III).

Figura 8
Estriem as duas estirpes listadas abaixo em meio sólido YPD e incubem a 30 °C durante ~48 h.
| Número da Estirpe | Designação da Estirpe | Vetor Plasmídeo | Caixa | Pos | ||
|---|---|---|---|---|---|---|
| µ1886 | CENPK111-32D | pTA1 | vetor vazio | Björn12 | 35 | |
| µ1885 | " | pTA1_TDH3_ScCTT1_PGI1 | vetor de expressão CTT1 | "" | 34 |
Inoculem dois tubos de vidro de 50 mL ou pequenos erlenmeyers com ~5 mL de meio SD e incubem a 30 °C com agitação durante ~48 h.
Rotulem os tubos com 1885 e 1886, respetivamente. Estas culturas podem ser guardadas a 4–8 °C no frigorífico durante ~3–4 semanas.
Esta etapa deve ser realizada na manhã do dia anterior à aula. Inoculem dois tubos de vidro de 50 mL com 5 mL do mesmo meio, utilizando 100 µL de cada pré-cultura.
Rotulem os tubos com 1885 e 1886.
Preparem 10 mL de solução de peróxido de hidrogénio (10 mM) adicionando 12 µL de peróxido de hidrogénio a 30% a 10 mL de tampão de fosfato 50 mM (pH 7.0). Distribuam ~1 mL da solução de peróxido em quatro tubos Eppendorf, um para cada grupo.
Meçam a densidade ótica (OD) a 640 nm para as culturas. Adicionem meio fresco à cultura com maior OD de forma a igualar a densidade ótica das duas culturas.
Preparem 50 mL de solução de trabalho. A ordem de adição dos componentes é importante:
- 2,5 mL de solução de cobalto (II) (3 x 834 µL)
- 2,5 mL de solução de sal de Graham (3 x 834 µL)
- 45 mL de solução de bicarbonato de sódio (completar com 3 x 834 µL)
Distribuam 5–10 mL da solução de trabalho em quatro tubos FALCON de 50 mL, um para cada grupo.
Esta solução deve ser armazenada à temperatura ambiente no escuro.
| Grupo | Número da Estirpe | Designação da Estirpe | Vetor Plasmídeo |
|---|---|---|---|
| 1 | µ1886 | CENPK111-32D | pTA1 (vetor vazio) |
| 2 | " | " | " |
| 3 | µ1885 | " | pTA1_TDH3_ScCTT1_PGI1 |
| 4 | " | " | " |
- Cada grupo (G1, G2, G3 e G4) deve retirar 1 mL da cultura indicada na tabela acima para um tubo Eppendorf vazio de 1,5 mL.
- Centrifuguem 🌀 a cultura durante 20 segundos numa microcentrífuga.
- Removam o sobrenadante com uma pipeta P1000.
- Adicionem 1 mL de tampão fosfato 5 mM.
- Ressuspendam as células pipetando para cima e para baixo com a mesma ponta.
- Centrifuguem 🌀 a cultura durante 20 segundos.
- Removam o sobrenadante.
- Adicionem 1 mL de tampão fosfato 5 mM.
- Ressuspendam as células.
- Transfiram 100 µL das células para um novo tubo Eppendorf.
- Adicionem 400 µL de água destilada (dH₂O).
- Adicionem 500 µL de etanol absoluto.
- Misturem o conteúdo do tubo com vórtex durante ~30 segundos.
- Incubem à temperatura ambiente durante 20 minutos no banco de trabalho.
- Marquem nove tubos Eppendorf vazios com um marcador: **Sa, Sb, **Sc, T1a, T1b, T1c, T2a, T2b, e T2c.
- Marquem nove cuvetes de plástico com as mesmas designações.
- Façam uma pausa ☕ até as células estarem prontas. A temporização não é crítica.
- Adicionem os componentes na tabela abaixo aos tubos marcados. Os volumes estão indicados em microlitros (µL). Preparem os tubos na ordem indicada (de cima para baixo) e adicionem os componentes pela ordem especificada (da esquerda para a direita). Lembrem-se de que a reação começa com a adição de peróxido, por isso façam esta adição rapidamente para todos os tubos.
| Rótulo | Amostra | Água | Células | Peróxido | Total |
|---|---|---|---|---|---|
| Sa | Standard | 70 | 0 | 140 | 210 |
| Sb | Standard | 70 | 0 | 140 | 210 |
| Sc | Standard | 70 | 0 | 140 | 210 |
| T1a | Teste 1a | 0 | 70 | 140 | 210 |
| T1b | Teste 1b | 0 | 70 | 140 | 210 |
| T1c | Teste 1c | 0 | 70 | 140 | 210 |
| T2a | Teste 2a | 35 | 35 | 140 | 210 |
| T2b | Teste 2b | 35 | 35 | 140 | 210 |
| T2c | Teste 2c | 35 | 35 | 140 | 210 |
- Incubem os tubos Eppendorf a 🌡️ 37 °C num banho-maria 🛁 durante 10 minutos. ⏱️ Este tempo é crítico!
- Adicionem 800 µL da solução de trabalho a cada tubo.
- Misturem invertendo os tubos.
- Incubem à temperatura ambiente durante pelo menos 10 minutos no escuro 🌙. Guardem os tubos numa gaveta vazia do laboratório.
- Centrifuguem 🌀 durante 20 segundos na velocidade máxima.
- Transfiram os sobrenadantes para as cuvetes marcadas da mesma forma. Tirem uma fotografia 📷 das cuvetes com o vosso telemóvel e façam upload para o Google Photos.
- Registem a absorbância de cada cuvete a 440 nm contra o ar. Coloquem a cuvete conforme as instruções do espectrofotómetro GENESYS20.
- Adicionem os dados à folha de cálculo do Google.
Esta aula prática baseia-se numa combinação de métodos descritos nas seguintes publicações:
-
Trawczyńska, I., & Wójcik, M. (2015). Optimization of permeabilization process of yeast cells for catalase activity using response surface methodology.
Biotechnology, Biotechnological Equipment, 29(1), 72–77.
Link -
Hadwan, M. H. (2018). Simple spectrophotometric assay for measuring catalase activity in biological tissues.
BMC Biochemistry, 19(1), 7.
Link
-
Kaplan, J. G. (1963). The reversion of catalase during growth of yeast in anaerobiosis.
The Journal of General Physiology, 47, 103–115.
Link -
Martins, D., & English, A. M. (2014). Catalase activity is stimulated by H(2)O(2) in rich culture medium and is required for H(2)O(2) resistance and adaptation in yeast.
Redox Biology, 2, 308–313.
Link
Todos os valores de absorbância são medidos num espectrofotómetro calibrado contra o ar, sem uma cuvete (Figura 10).
A reação Standard na Figura 10 contém apenas peróxido de hidrogénio e carbonato de cobalto(II). Todo o peróxido disponível deve oxidar o cobalto(II) para cobalto(III).
As reações Teste contêm H2O2 e células. Parte do peróxido deverá ter sido consumida pela catalase nas células, pelo que o valor da absorbância a 440 nm deverá ser inferior ao da reação Standard.
A absorbância que deveria ter sido observada para o H₂O₂ consumido é a diferença entre a absorbância da reação Standard e a reação Teste. Espera-se uma absorbância mais elevada para o Teste 2, pois uma menor quantidade de células deve consumir menos peróxido.

Figura 9
Utiliza-se uma curva padrão (Figura 11) para calcular a concentração real das amostras. A atividade é então calculada a partir da diferença de concentração entre o Standard e a amostra, dividida pelo tempo da reação.
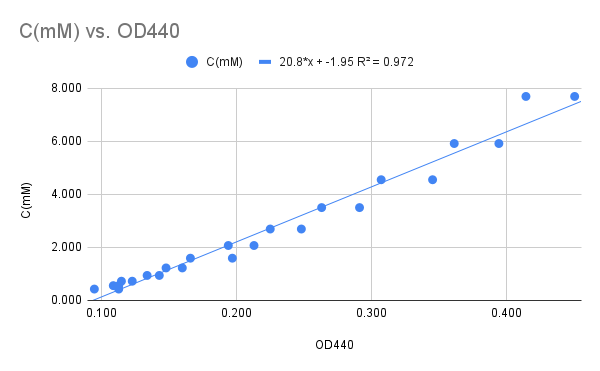
Figura 10
Uma solução de peróxido de hidrogénio a 10 mM foi diluída em série (Figura 11), começando por preparar doze tubos Eppendorf com 300 µL de água destilada. Um mililitro de peróxido de hidrogénio foi transferido para o primeiro tubo. O conteúdo foi misturado pipetando 5–6 vezes, seguido de uma transferência de 1 mL para o tubo seguinte. No último tubo (12), o volume final foi 1,3 mL, enquanto nos tubos anteriores foi 300 µL. A concentração no primeiro tubo foi calculada sera 1 mL * 10 mM/1.3 mL = 7.6923 mM. O fator de diluição foi constante (1/1.3). A concentração de cada tubo foi calculada pela fórmula:
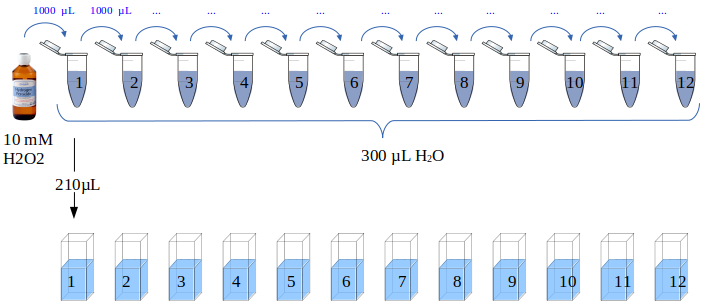
Figura 11


Figure 12
As medições de absorbância foram coletadas na tabela abaixo:
| Tubo | Concentração (mM) | Série#1 | Série#2 |
|---|---|---|---|
| 1 | 7.692 | 0.450 | 0.414 |
| 2 | 5.917 | 0.394 | 0.361 |
| 3 | 4.551 | 0.345 | 0.307 |
| 4 | 3.501 | 0.291 | 0.263 |
| 5 | 2.693 | 0.248 | 0.225 |
| 6 | 2.072 | 0.213 | 0.194 |
| 7 | 1.594 | 0.197 | 0.166 |
| 8 | 1.226 | 0.160 | 0.148 |
| 9 | 0.943 | 0.143 | 0.134 |
| 10 | 0.725 | 0.123 | 0.115 |
| 11 | 0.558 | 0.109 | 0.113 |
| 12 | 0.429 | 0.113 | 0.095 |
O protocolo especifica dois experimentos (Figura 6), Teste 1 e Teste 2, onde o último contém metade das células. Se o ensaio for linear, o Teste 1 deverá produzir o dobro da absorbância do Teste 2.

Figura 13
dH2O 4 x 40 mL
- 6.7 g/L Yeast Nitrogen Base (YNB) WITHOUT AMINO ACIDS
- 20 g/L glucose
10 x 50 mL glass culture tubes with cotton stopper or aluminium cap
25 mL Ethanol 95-99% (2 courses * 3 shifts * 4 groups * 0.5 mL = 12 mL)
Six empty new FALCON tubes 50 mL
This buffer can be prepared by by mixing two solutions in ultrapure water:
- 100 mL 6.81 g/L KH2PO4
- 100 mL 8.90 g/L K2HPO4
300 mL Sodium bicarbonate (NaHCO3) solution
Prepared by dissolving 24 g (MW 84.01 g/mol) in 300 ml ultrapure water. This solution should be stored at room temperature.
Prepared by dissolving 0.51 g of Co(NO3)2 x 6H2O in 25 ml of distilled water. This solution should be stored at room temperature in the dark.
Prepared by dissolving 0.25 g of (NaPO3)6 in 25 ml of distilled water. This solution should be stored at room temperature.
- Eppendorf tubes 1.5 mL (new, not sterile)
- Blue tips
- Yellow tips
- Plastic cuvettes
- 37 °C water bath
- boat for cuvettes
- microcentrifuge
- vortex
- P1000 pipettes
- P200 pipettes
Estriar as duas estirpes abaixo em meio sólido YPD e incubar a 30 °C por ~48 h.
| Número da Estirpe | Designação da Estirpe | Vetor Plasmídeo | caixa | pos | |
|---|---|---|---|---|---|
| µ1886 | CENPK111-32D | pTA1 | vetor vazio | Björn12 | 35 |
| µ1885 | " | pTA1_TDH3_ScCTT1_PGI1 | vetor de expressão CTT1 | "" | 34 |
Inocular dois tubos de vidro de 50 mL com ~5 mL de meio SD e incubar a 30 °C por ~48 h.
Rotular os tubos 5 e 6 para µ1885 e µ1886, respetivamente. Estas culturas podem ser mantidas a 4-8°C no frigorífico durante ~3-4 semanas.
Esta etapa deve ser realizada na manhã do dia anterior à aula. Inocular dois tubos de vidro de 50 mL com 5-10 mL do mesmo meio usando 100 µL de cada pré-cultura. Rotular os tubos com 5 ou 6.
- 6,7 g/L de Base de Nitrogénio de Levedura (YNB) SEM AMINOÁCIDOS
- 20 g/L de glicose
10 x 50 mL tubos de cultura de vidro com rolha de algodão ou tampa de alumínio
25 mL de Etanol 95-99% (2 cursos * 3 turnos * 4 grupos * 0,5 mL = 12 mL)
Seis tubos FALCON novos e vazios de 50 mL
Este tampão pode ser preparado misturando duas soluções em água ultrapura:
- 100 mL de 6,81 g/L de KH2PO4
- 150 mL de 8,90 g/L de Na2HPO4
300 mL de solução de Bicarbonato de Sódio (NaHCO3)
Preparada dissolvendo 24 g (PM 84,01 g/mol) em 300 mL de água ultrapura. Esta solução deve ser armazenada à temperatura ambiente.
Preparada dissolvendo 0,51 g de Co(NO3)2 x 6H2O em 25 mL de água destilada. Esta solução deve ser armazenada à temperatura ambiente no escuro.
Preparada dissolvendo 0,25 g de (NaPO3)6 em 25 mL de água destilada. Esta solução deve ser armazenada à temperatura ambiente.
- Tubos Eppendorf de 1,5 mL (novos, não estéreis)
- Pontas azuis
- Pontas amarelas
- Cuvetes de plástico
- Banho-maria a 37 °C
- Barcos para tubos
- Microcentrífuga
- Vórtex
- Pipetas P1000
- Pipetas P200
