固体物理学笔记 - johanzumimvon/Johan-zumimvon-Christianity GitHub Wiki

レㇴナド·ヨㇴ势,是用来模拟两个电中性的分子或原子间相互作用势能的一个比较简单的数学模型。最早由数学家约翰·兰纳·琼斯(ヨㇴ·レㇴナド·ヨㇴ)提出于1924年。
我发现Jones的发音、写法类似于john、johan、Johannes。很显然,Jones既有约翰、佑翰、ヨハㇴ之義!就是指被上帝祝福的!
其中,k是系数;l是二者处于能量状态最低时的距离;x是二者之间的实际距离。
F=−kx
纯净物的晶体缺陷分为弗伦克尔缺陷(ㇷレㇴケㇾ缺陷,杂位)、肖特基缺陷(ソ゚ㇳキ缺陷,空位)、位错
堆积种类列表
| 种类 | 他名 | 每晶胞的粒子数 | 配位数 | 空间利用率 | 十二进制 | 公式 | 常见物质 |
|---|---|---|---|---|---|---|---|
| 随机堆积 | 非晶态 | 0.59~0.64 | 0;71~0;78 | 约0;74 | 非晶态金属 | ||
| 金刚石式堆积 | 8 | 4 | 0.34 | 0;4 | 金刚石, 单晶硅, 灰锡 | ||
| 简单立方堆积 | 立方 | 1 | 6 | 0.52 | 0;63 | 钋, 超高压简并态硫 | |
| 体心堆积 | 2 | 8 | 0.68 | 0;8 | 钠, 钾, 铷, 铯, 铁, 钒, 铌, 钼, 钨 | ||
| 面心最密堆积 | イロハ堆积 | 4 | 12 | 0.74 | 0;9 | 铝, r铁, 镍, 铜, 银, 金 | |
| 六方最密堆积 | イロイロ堆积 | 2 | 12 | 0.74 | 0;9 | 镁, 钛, 锌, 镉 |
其中, 简单立方堆积很少见; 体心立方堆积容易出现螺旋位错; 六方最密堆积对称性弱, 易断裂.
r铁是指910℃~1390℃的铁单质.
如果是按教科书上的图, 也就是六方最密堆积的大的晶胞, 则粒子数目为6
位于任意晶胞内部的粒子, 数目为1
位于任意晶胞面上的粒子, 数目为
位于长方体或者正方体晶胞棱上粒子, 数目为
位于正六边体晶胞顶棱上的粒子, 数目为
位于正六边体晶胞侧棱上的粒子, 数目为
位于长方体或者正方体顶点上的粒子, 数目为
位于正六边体晶胞顶点上的粒子, 数目为
最密堆积常数
π÷(3√2)=0;8∗7672∗89911
1÷ζ(2)=0;7365#8723717
体心堆积常数
(√3)π÷8=0;81#412#56925
简单立方堆积(釙堆积)常数
0;2π=0;6349416967#6
金刚石堆积常数
体心堆积常数÷2=0;40#807589472
随机堆积
0;71~0;78
| 形式 | 图片 | 每晶胞的粒子数 | 抽象 | 抽象晶格式 | イ之配位数 | ロ之配位数 | 同结构的物质 | 对偶式 | 抽象对偶式 | 对偶イ之配位数 | 对偶ロ之配位数 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| NaCl式 | Na₄Cl₄ | イロ | イ₄ロ₄ | 6 | 6 | LiCl, KCl, RbCl, NaH, NaF, MgO | NaCl | イロ | 6 | 6 | |
| CsCl式 |  |
CsCl | イロ | イロ | 8 | 8 | CsBr, CsI, TlCl, TlBr, 高压下的RbCl | CsCl | イロ | 8 | 8 |
| 金红石式 | Ti₂O₄ | イロ₂ | イ₂ロ₄ | 6 | 3 | GeO₂, SnO₂, MnO₂, MoO₂, WO₂, TcO₂, CoO₂, MgF₂, MnF₂, FeF₂, CoF₂, ZnF₂ | |||||
| CaF₂式 | Ca₄F₈ | イロ₂ | イ₄ロ₈ | 8 | 4 | CeO₂, ThO₂, SrF₂, 立方相二氧化锆, 立方相二氧化铪 | Li₂S, Na₂S, K₂S, Rb₂S, Cs₂S | イ₂ロ | 4 | 8 | |
| MgB₂式 | Mg₃B₆ | イロ₂ | イ₃ロ₆ | 12 | 6 | ReB₂, ZrB₂, HfB₂, AlB₂ | |||||
| 立方ZnS式 | 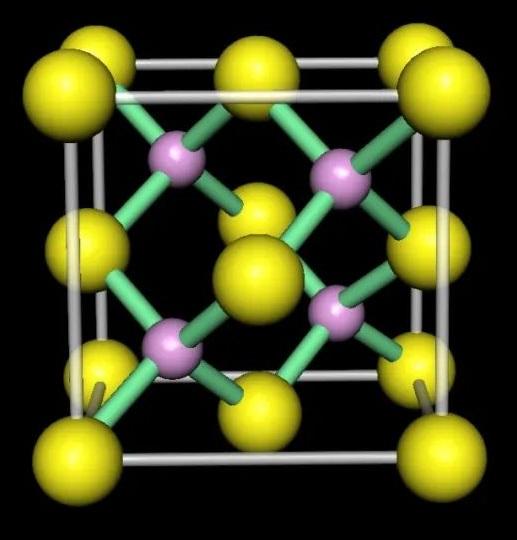 |
Zn₄S₄ | イロ | イ₄ロ₄ | 4 | 4 | CuCl | ZnS | イロ | 4 | 4 |
| 六方ZnS式 |  |
Zn₂S₂ | イロ | イ₂ロ₂ | 4 | 4 | ZnS | イロ | 4 | 4 | |
| 钇钡铜氧式 |  |
YBa₂Cu₃O₇ |
氯化铵NH₄Cl采用氯化铯式排列
在高温高压, RbCl形成CsCl式结构在高压下NaCl 和 KCl 会形成此结构. 氯离子在立方晶系的八个顶点包围着立方体中央的RbPiRb⁺, 这是RbCl密度最高的结构. 因为一个立方体有八个顶点, 所以两种离子的配位数等于8. 这是RbCl的最高可能配位数. 因此, 根据半径比规则radius ratio rule, 阳离子在这种晶型将达到最大表面半径, 因为阴阳离子的距离是最大的.
YBa₂Cu₃O₇中, 有二铜为正二价; 有一铜为正三价.
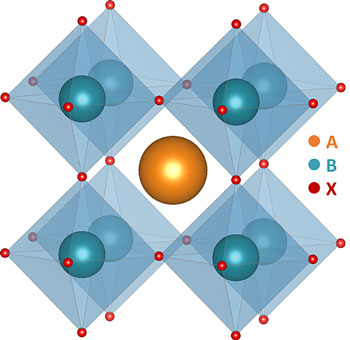
钙钛矿, 又名perovskite, ペローㇲキㇳ. 最早由ロシア科学家Lev Perovski(レㇷ·ペローㇲキ)發现.
| CaTaNO₂ | ペローㇲキㇳ | |
|---|---|---|
| 晶胞 |  |
|
| 晶胞式 | Ca₂Ta₂N₂O₄ | イロハ₃ |
| イ配位数 | 12 | 12 |
| ロ配位数 | 6 | 6 |
| ハ配位数 | 6 | 6 |
| ニ配位数 | 6 | |
| 其他物质 | LaTaON₂ | CaTiO₃, SrTiO₃, |
| 形式 | イ坐标 | ロ坐标 |
|---|---|---|
| 氯化钠 | (1,0,0), (0,1,0), (0,0,1), (1,1,1) | (0,0,0), (0,1,1), (1,0,1), (1,1,0) |
| 氯化铯 | (1,1,1) | (0,0,0) |
钙, 锶, 铝, 铅, 氖, 氩, 氪, 氙, 镍, 铜, 铑, 钯, 银, 铱, 铂, 金, 铈, 镱, 锕, 钍
铍, 镁, 钛, 钴, 锌, 锆, 锝, 钌, 镉, 铪, 铼, 锇, 钪, 钇, 镧, 镨, 钕, 钷, 钆, 铽, 镝, 钬, 铒, 铥
钋
| 种类 | 例 |
|---|---|
| 分子晶体 | 水, 二氧化碳, 氯化氢, 氟化氢, 无水氯化铝, 无水氯化镓, 无水氯化铁 |
| 离子晶体 | 乙酸钠, 氯化钠, 氯化钾等等大多数盐类, 强碱, 氧化镁, 氧化钙, 氧化钠, |
| 原子晶体 | 金刚石, 单晶硅, 碳化硅, 石英水晶, 二氧化锆, 二氧化铪, 三氧化二铝, 二氧化锡, 硫化汞, 硫化铜, 硫化银 |
| 金属晶体 | 金属互化物, 大多数金属单质 |
| 混合键型晶体 | 石墨, 钋, 六方氮化硼, 二硼化镁, 二硼化铼, 氯化银, 溴化银, 碘化银, 丁酸钠, 硬脂酸钠, 硬脂酸钾, 硬脂酸钙, 软脂酸钠, ionic liquid |
分子晶体中的挑战常规者
大多硬度、熔点、沸点、华点比如亁冰的升华温度低, 但也有例外: 五氧化二磷, 酞菁蓝, 酞菁绿, 还原黑25, 颜料紫23, 颜料黄138等等有机颜料类化合物.
比如酞菁蓝的熔点就可达600℃, 也就是约900开氏度, 已经超过某些原子晶体和离子晶体的熔点了, 比如硫化汞的580℃、甲酸铯KHCO₂的263℃, 高铼酸钾KReO₄的555℃; 被氯全部取代得到的酞菁绿, 其熔点应该超过了碘化铯, 甚至氯化钠.
大多熔点、沸点很高, 硬度高但是脆, 但也有例外, 比如甲酸铯、乙酸铯、丙酸铯、丙酸钙、丙酸钠、甲醇铯
熔点高, 大多数硬度高、脆
大多熔沸点高, 硬度高且有韧性, 但也有不少例外, 比如锂, 钠, 钾, 铷, 铯, 钫, 镓, 锗, 铟, 锡. 镓容易变成液态且存在过寒亚稳态.
晶态, 准晶体, 非晶态, 液体, 气体, 超临界体, 等离子体, 超固体, 中子态, 夸克汤, 黑洞, 液晶, 超流体, 玻色__爱因斯坦凝聚态, 费米凝聚态, 色超导体, 碱金属在即将熔化时形成的物态
离子键缺少方向性, 缺少饱和性.
金属键缺少方向性, 缺少饱和性. 金属键由自繇电子构成. 金属键可發生镜像反射, 其入射角等于反射角, 且位于同一平面, 垂直於镜面.
由イ、ロ二原子共用电子形成, 有方向性、饱和性. 氢气分子的共价键没有方向性, 且其旋转能量取值为量子化.
不同的原子可以形成不同的共价键, 如下表
| 共价键数 | 元素种类 |
|---|---|
| 1 | 氢, 锂, 钠, 氟, 氯, 溴, 碘 |
| 2 | 大多数短强氢键中的氢, 氧, 镁, 硫 |
| 3 | 分叉短强氢键中的氢, 氮, 磷, Na₂SO₃中的硫, 亚砜中的硫, H₃OPi中的氧 |
| 4 | 碳, 硅, Na₃PO₄中的磷, Na₂SO₄中的硫, 砜中的硫, NaClO₄中的氯, NH₄中的中的氮 |
| 5 | (CH₅)₂[B₁₂F₁₂]中的碳 |
| 6 | 钋, 六氟化硫中的硫, H[CB₁₁F₁₂]中的硼、碳 |
| 8 | 体心立方堆积 |
| 12 | 最密堆积 |
对于共价键, 其电子会偏向高电负性的元素, 元素的电负性的降序排列如下
氟 氧 氮 氯 溴 碘 硫 硒 碳 氢 磷 硼 硅

元素周期表中, 之于主族元素, 愈是右上角, 电负性愈大.
氮的电负性大于氯的电负性, 是因为对于NCl₃, 其水解产物如下
NCl₃ + 3H₂O ══ NH₃ + 3HOCl
也就是NCl₃水解并没有生成亚硝酸, 反而生成了次氯酸严谨地说, 次氯酸应该写作「HOCl」而不是「HClO」, 因此氮的电负性大于氯的电负性.
另外, 氮在形成杂环之後, 电负性会一晃而过, 甚至与逼近于氧.

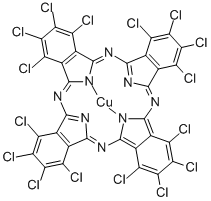
由イ原子提供给二个或多个电子给ロ原子, 比如酞菁铜、NH₄Pi, [Cu(NH₃)₄]Pi₂, [Al(OH)₄]E等等. 中括号裡边为内界; 外边为外界; イ原子为配体; ロ原子为受体; ロ原子连接的イ原子数目为配位数.
| 名称 | 化学式 | 化学式简 | 内界 | 外界 | 配位 | 受体 | 配位数 |
|---|---|---|---|---|---|---|---|
| 全氯酞菁镱 | [YbC₃₂N₈Cl₁₆] | [YbPch] | YbPch | Pch²⁻ | Yb²⁺ | 4 | |
| 酞菁铜 | [CuC₃₂N₈H₁₆] | [CuPc] | CuPc | Pc²⁻ | Cu²⁺ | 4 | |
| 氢氧化铜氨 | Cu(NH₃)₄(H₂O)₂₂ | Cu(NH₃)₄(H₂O)₂²⁺ | OH⁻ | NH₃ | Cu²⁺ | 6 | |
| Na[Ga(OH)₄] | [Ga(OH)₄]⁻ | Na⁺ | OH⁻ | Ga³⁺ | 4 | ||
| 氢氧配位镱 | Na₃[Yb(OH)₆] | [Yb(OH)₆]³⁻ | Na⁺ | OH⁻ | Yb³⁺ | 6 |
氢键, 本来是相互作用, 但某些情况也会变成化学键, 比如NaHF₂中的氢键.

配位数为3的短强氢键
| 种类 | 形态 | 例 |
|---|---|---|
| sp | 直线 | 乙炔, 气相氯化钙, 二氟化汞, 气相二氯化铍 |
| sp² | 角, 三角形 | 乙烯, 三氟化硼, 碳酸根, 硝酸根, 亚硝酸根, 臭氧, 羧基 |
| sp³ | 固体, 锥, 角 | 乙烷, 甲烷, 连氨(hidlaʦin), 氨, 水, 氟化氢, 氯化氢, 磷酸根, 硫酸根, 高氯酸根, 高铼酸根, 鋶, 鏻 |
| 几乎不發生杂化 | 硫化氢, 硒化氢, 磷化氢 |
愈右则愈小, 此处的原子半径是指单独时的原子半径; 在分子モレクラ中, 氟的原子半径稍大于氢
单独的原子半径
He Ne F O H N C Ar Cl etc Rb Cs
化合物中的原子半径
H F O N C B Cl S P Si
对于主族元素, 愈左则原子半径愈大; 对于副族元素, 愈左则原子半径一般增大, 例外位于镧系元素中, 也就是r(Pr)>r(Ce)>r(Nd), r(Ba)>r(Eu)>r(Yb)>r(La)

虽然稀有气体不能得到共价半径, 但毫无疑问, 同周期中, 稀有气体半径最小
1
He H
2
Ne F O N C B Be Li
3
Ar Cl S P Si Al Mg Na
4
Kr Br Se As Ge Ga Zn Cu Ni Co Fe Mn Cr V Ti Sc Ca K
5
Xe I Te Sb Sn In Cd Ag Pd Rh Ru Tc Mo Nb Zr Y Sr Rb
6
Rn At Po Bi Pb Tl Hg Ag Pt Ir Os Re W Ta Hf Lu Tu Er Ho Dy Tb Gd Sm Pm Nd Ce Pr La Yb Eu Ba Cs
同族元素愈下则原子愈大, 有时会出现次级周期律, 也就是r(Al)>r(Ga), r(Y)>r(Lu); 由于相对论效应, r(Cs)>r(Fr), r(Ba)>r(Ra).
相对于铝元素アルーミニュㇺ, 镓元素ガㇻ̲リュㇺ之所以更难失电子, 是因为镓经过是钪系收缩.
地壳中, 镓主要分散在铝矿中, 在用碱处理铝土矿主要成分是Al₂O₃ ,含少量Ga₂O₃时得Na[Al(OH)₄]与Na[Ga(OH)₄]. 通入CO₂, 得更弱的弱酸Al(OH)沉淀; 而Na[Ga(OH)₄]留在母液中. 母液经多次循环, 含镓量增大到一定程度成为提镓的原料.
1
H Li Na K Rb Fr Cs
2
Be Mg Ca Sr Ra Ba
3
Sc Lu Y
4
Ti Zr Hf
5
V Nb Ta
6
Cr Mo W
7
Mn Tc Re
8
Fe Ru Os
9
Co Rh Ir
10
Ni Pd Pt
11
Cu Ag Au
12
Zn Cd Hg
13
B Ga Al In Nh Tl
14
C Si Ge Sn Pb
15
N P As Sb Bi
16
O S Se Te Po
17
F Cl Br I At
18
He Ne Ar Kr Xe Rn
此处的离子半径, 其实是化合物中的离子半径.
如果规定诸如 0−εi>−i>−2i>−3i>−4i>etc>−∞i>+∞>正实数>0>−1>−2>−etc>−∞的话, 理论模型也是成立. 比如氧的离子半径实际上大于任何实数.
神奇的虚数之氧离子的半径
由于氧原子得到第二个电子是吸热反应, 所以氧离子的玻尔半径是负的虚数值. 正是因为氧离子的玻尔半径是负的虚数值, 所以氧的反应活泼性远远小于氟元素, 也明显小于氯溴碘元素, 虽然氧元素的电负性明显大于氯元素, 甚至连氮元素的电负性也稍大于氯元素.
氮元素得到三个电子生成N³⁻会吸收更多的能量, 导致氮气更加不活泼, 使得生成氮化钠、氮化钾、氮化铷、氮化铯的反应变成吸热反应, 所以氮无法与金属钠反应.
氮可以与锂、碱土金属反应
由于铍、钡、钫ㇷラㇴキュㇺ、镭是剧毒元素或不稳定元素, 所以不介绍其相关的反应式
锂 之 燃烧 于 氮气
6Li+N₂ ══(点燃)2Li₃N
镁 之 燃烧 于 氮气
3Mg+N₂ ══(点燃)Mg₃N₂
復有
3Ca+N₂ ══(点燃)Ca₃N₂
3Sr+N₂ ══(点燃)Sr₃N₂
氧离子的玻尔半径
r(O²⁻)
≈−0;000000000384i m(十二进制)
≈−1;17i a₀(十二进制)
使用虚数是因为氧得到第二个电子是吸热反应, 反映了氧离子衹能存在于化合物中.
十进制取值为−0.000000000060 i m
氧离子玻尔半径的数据来源
r(O²⁻)
$\mathrm{=r(Ne)\sqrt{\frac{氖的第一电离能}{氧的第二电子亲和能}}}$
$\mathrm{=38皮米\sqrt{\frac{2080.7}{−844.2}}}$ =−59.657583 i 皮米
=−0.000000000060 i m
以下是离子半径的升序排列, 也就是越往右越大
H⁺ Be²⁺ Al³⁺ Cu³⁺ Nb⁵⁺ Ta⁵⁺ Zr⁴⁺ Hf⁴⁺ Mg²⁺ Cu²⁺ Cu⁺ Li⁺ Dy⁴⁺ Tb⁴⁺ Pr⁴⁺ Ce⁴⁺ Yb²⁺ Ca²⁺ Na⁺ Sr²⁺ Ra²⁺ Ba²⁺ K⁺ NH₄⁺ Rb⁺ Fr⁺ Cs⁺ H⁻ F⁻ Cl⁻ Br⁻ I⁻ O²⁻ S²⁻ Se²⁻ Te²⁻ N³⁻ P³⁻
同族元素, 愈下则离子半径愈大
H⁺ Li⁺ Na⁺ K⁺ Rb⁺ Fr⁺ Cs⁺
钫的离子半径之所以大于铯的离子半径, 是因为相对论效应. 不仅如此, 钫的电负性也大于铯. 铯是最容易失电子的元素.
Be²⁺ Mg²⁺ Ca²⁺ Sr²⁺ Ra²⁺ Ba²⁺
F⁻ Cl⁻ Br⁻ I⁻ At⁻
化合价愈高, 原子半径愈小
Fe³⁺ Fe²⁺ Fe⁺ Fe
Cu⁴⁺ Cu³⁺ Cu²⁺ Cu⁺ Cu
Ce⁴⁺ Ce³⁺ Ce
越往右, 离子半径越小
N⁵⁺ C⁴⁺ B³⁺ Be²⁺ Li⁺ He H⁺
Si⁴⁺ Al³⁺ Mg²⁺ Na⁺ Ne F⁻ O²⁻ N³⁻ C⁴⁻ B⁵⁻
Cr⁶⁺ V⁵⁺ Ti⁴⁺ Sc³⁺ Ca²⁺ K⁺ Ar Cl⁻ S²⁻ P³⁻ Si⁴⁻
Mo⁶⁺ Nb⁵⁺ Zr⁴⁺ Y³⁺ Sr²⁺ Rb⁺ Kr Br⁻ Se²⁻
Ta⁵⁺ Hf⁴⁺ Lu³⁺ Yb³⁺ Tu³⁺ Er³⁺ Ho³⁺ Dy³⁺ Tb³⁺ 六四³⁺ Eu³⁺ Sm³⁺ Pm³⁺ Nd³⁺ Pr³⁺ Ce³⁺ La³⁺ Ba²⁺ Cs⁺ Xe I⁻ Te²⁻
升序, 愈右者, 酸性愈强
同族者, 愈下愈易發生化学键断裂, 酸性愈强.
HF HCl HBr HI
H₂O H₂S H₂Se
NH₃ PH₃
同周期者, 愈右则愈易自偶电离, 酸性愈强
NH₃ H₂O HF
PH₃ H₂S HCl
同元素含氧酸, 氧愈多则酸德愈强
HOCl HClO₂ HClO₃ HClO₄
周期最高价含氧酸, 愈嚮右则酸德愈强
B(OH)₃ H₂CO₃ HNO₃
Al(OH)₃ H₄SiO₄ H₃PO₄ H₂SO₄ HClO₄
Al(OH)₃会形成Na[Al(OH)₄]; 硼酸会形成Na[B(OH)₄].
共价键是指原子共用二个电子形成的化学键,由于共价键与离子键之间没有严格界限,所以存在超价分子,比如六氟化硫。这意味着八隅律的成立是有限格的!
共用二个电子是单键,也就是シコマ键;
共用四个电子就是双键,也就是1シコマ键+1ピー键;
共用六个电子就是叁键,也就是1シコマ键+2ピー键
共用八个电子就是肆键,也就是1シコマ键+2ピー键+1伝ㇾタ键。
配位键可以看作一个原子向另一个原子提供了二个电子,最终结果是形成了共价键。
有时候会出现共用奇数个电子的情形,比如氧气有一个シコマ共用二个电子;有二个ピー键且每个共用3个电子。使得氧表现出顺磁性。
一氧化氮、二氧化氮存在共用奇数电子成键的情形,但其皆有一定的稳定性。
![[HF₂]⁻](https://private-user-images.githubusercontent.com/167794740/399871011-80d47528-4307-4f0c-9f0f-87317f96f591.jpg?jwt=eyJ0eXAiOiJKV1QiLCJhbGciOiJIUzI1NiJ9.eyJpc3MiOiJnaXRodWIuY29tIiwiYXVkIjoicmF3LmdpdGh1YnVzZXJjb250ZW50LmNvbSIsImtleSI6ImtleTUiLCJleHAiOjE3NjIxNDQ2ODMsIm5iZiI6MTc2MjE0NDM4MywicGF0aCI6Ii8xNjc3OTQ3NDAvMzk5ODcxMDExLTgwZDQ3NTI4LTQzMDctNGYwYy05ZjBmLTg3MzE3Zjk2ZjU5MS5qcGc_WC1BbXotQWxnb3JpdGhtPUFXUzQtSE1BQy1TSEEyNTYmWC1BbXotQ3JlZGVudGlhbD1BS0lBVkNPRFlMU0E1M1BRSzRaQSUyRjIwMjUxMTAzJTJGdXMtZWFzdC0xJTJGczMlMkZhd3M0X3JlcXVlc3QmWC1BbXotRGF0ZT0yMDI1MTEwM1QwNDMzMDNaJlgtQW16LUV4cGlyZXM9MzAwJlgtQW16LVNpZ25hdHVyZT00YTZmZDNlMjk0MjNhYmYyNTI0MDE3MWE0ZmNiZmI4NjJkZjhlNTc4MDRmN2YwN2FkZjBmZGFiYjZjOWZhYzliJlgtQW16LVNpZ25lZEhlYWRlcnM9aG9zdCJ9.bqOXRVKX4m2YXUuWzlaMa2BC4TLEwDo26mE53jFpMno)
[HF₂]⁻
六氟化硫(化学式:SF₆)是一种无色、无味、无毒的气体,不可燃,微溶于水。分子为八面体构型,属于超价分子,无极性。六氟化硫是常用的致冷剂及输配电设备的绝缘与防电弧气体,但它也是很持久的温室气体,效果22800倍于二氧化碳。
六氟化硫是密度最大的稳定气体。如果将与水反应的气体算进去,则六氟化钨是密度最大的气体。
从结构上来看,六氟化硫可以看成1个S⁶⁺被6个氟离子(F⁻)死死包围的高度对称结构,可以看成具有离子化合物特征的分子,其中的S⁶⁺半径很小,周围被6个氟离子对称地死死包围住,使得其很难被水解。
六氟化硫由单质化合制取,反应也会生成硫的其他氟化物如十氟化二硫,可通过加热使其歧化后,再用氢氧化钠处理除去剩余的四氟化硫而纯化。由于六氟化硫对称性极高且被硫死死地包围,所以六氟化硫不会被氢氧化钠水解。
因为六个氟原子死死地包围了硫原子,所以六氟化硫是个极为惰性的气体,不与水、盐酸、氢氧化钠、金属钠(小于250℃,523K)、铜银铁铝(小于300℃,573K)作用,但会与金属锂反应并放热,也会与液氨中的钠反应(大于负64℃,209K)。
六氟化硫的一氯代物(SF₅Cl)可以用四氟化硫为原料制备,结构类似于六氟化硫,但由于其分子对称性差,所以其具有强反应性、强氧化性,很快水解生成硫酸盐。
吸入六氟化硫后声音变粗(频率降低),因为六氟化硫气体的重量使人的声带中声波的频率降低一半,正好相反于吸入氦气后声音变细(频率升高)。
由于其是密度最大的稳定气体,所以其甚至可以托起铝箔做的船。这个实验说明了气体也会产生浮力。
对于空气,1立方米的物体可以排开1立方米的空气,其会产生1.3㎏·9.8N·㎏⁻¹≈12.75牛的浮力;人体体积大约6斗(6トー),也就是0.06立方米(1トー=0.01m³),可以产生大约0.75N浮力。
原硝酸盐(Ortonitrate),化学式NO₄³⁻,是原硝酸的盐。1977年,原硝酸盐首次被发现,目前只有得到二种原硝酸盐:原硝酸钠 (Na₃NO₄) 和原硝酸钾 (K₃NO₄)。对应的酸原硝酸(Orthonitric acid),也称作正硝酸,是一种氮的含氧酸,化学式为H₃NO₄。由于原硝酸会脱水生成硝酸,目前还没有制得这种酸。原硝酸钠和原硝酸钾可以由对应的金属硝酸盐和金属氧化物在高温和高压(数GPa)下反应而成。
NaNO₃ + Na₂O ══(300℃) Na₃NO₄
原硝酸钠为白色晶体,对二氧化碳和水极敏感:
Na₃NO₄ + CO₂ ══ NaNO₃ + Na₂CO₃
原硝酸钠加热时分解:
2Na₃NO₄ ══(500℃) 2NaNO₂ + 2 Na₂O +O₂↑
原硝酸根离子具有正四面体构型,键长出乎意料地小,只有139pm。这说明N─O单键具有显著的极性相互作用,因为氮原子的d轨道(3d)能量太高几乎不能参与成键。
原硝酸根离子NO₄³⁻可以被看作四氟化碳CF₄的等电子体,也可以被看作N⁺与四个O⁻成键的产物,也可以被看作N⁵⁺与四个O²⁻形成配位键的产物。
这也说明在解释磷酸根、硫酸根、高氯酸根离子键长缩短、稳定性升高等等事实时无需引入d─pπ键的概念,直接按等电子体来解释就可以了。
"未解决的化学问题:超价分子中化学键的本质究竟是什么?"
超价分子多出现于二种元素电负性相差较大的情况下,比如高氯酸为HClO₄,高溴酸为HBrO₄,到了高碘酸,HIO₄会倾向于水合形成H₅IO₆。这是因为碘与氧的电负性相差较大,更加接近于离子键,更容易形成高配位(超价分子)。
超价分子的存在反映了共价键与离子键之间没有严格的界限,也反映了传统八隅体理论的局限性。比如NaHF₂中,由于氟的电负性远远大于氢,使得氟与氢之间的共价键有些离子键的成分,从而使得氢可以有4个电子,也就是四隅体。因为氢一般是二隅体。在分叉氢键中,氢甚至可以是六隅体,也就是在化合物中氢可以有6个核外电子,严重地违反了二隅律,比如颜料黄138中连接氮原子的氢就是如此。

颜料黄138
对于超价分子,我士大夫以耶稣之名,抛弃人间一切成见,以一个小孩子的天性探索超价分子,发现超价分子可以理解为:
冰晶石Na₃AlF₆
六氟硅酸钠Na₂SiF₆
六氟磷酸钠NaPF₆
六氟化硫SF₆
氟锑酸氯氟鎓ClF₆SbF₆
其中,ClF₆⁺的源头ClF₇无法稳定存在,这是因为氯的得电子性足够大,且ClF₇的对称性弱,所以其不稳定。
或者这样理解:
氧化钠是离子化合物,但也有轻微的共价化合物的性质,甚至氟化铯、氯化铯也至少有0.05的共价化合物的性质。
氧化镁、氧化镧是有一些共价性质的离子化合物。氧化镁配位数为6,为十二隅体,违背八隅律。
氧化铝、二氧化锆、二氧化铪是介于离子化合物与共价化合物的物质,导致其具有很高的熔点、很强的硬度(石K),其緻密形态难以与酸碱反应。α形态氧化铝的配位数为6,为十二隅体,违背八隅律。
二氧化硅、五氧化二钽、TaNO(氮氧化钽,用于与碳酸钙共热生产CaTaNO₂)、二氧化钛、氧化镓是有一些离子性质的共价化合物,其开始表现出明显的共价化合物性质,酸性(形成酸根阴离子)开始占上风了。二氧化硅满足八隅律。
五氧化二磷也就是十氧化四磷,属于共价化合物,如果将其所谓的双键视为配位键,则其满足八隅律,但其依然有一些离子化合物的一些性质,所以其熔点可达569℃。
三氧化硫是共价化合物,如果将固态三氧化硫的所谓的双键视为配位键,则三氧化硫满足八隅律。气态三氧化硫可以视为碳酸根离子的等电子体,满足八隅律。 七氧化二氯是共价化合物,如果将形式上的双键视为配位键,则七氧化二氯满足八隅律。
可以看到,铝、硅、磷、硫、氯的得电子性远远小于氟元素,使其共价键更像离子键,所以允许铝、硅、磷、硫、氯违背八隅律,也允许氢违背二隅律。
氧族元素中,氧能形成二甲醚O(CH₃)₂,硫能形成二甲硫醚S(CH₃)₂,硒能形成二甲硒醚Se(CH₃)₂,碲既能形成二甲碲醚Te(CH₃)₂,又能形成六甲基碲Te(CH₃)₆。也把电了碲有强的金属性,倾向于形成离子键。其中,不论用何种模型计算,六甲基碲Te(CH₃)₆是真的违反了八隅体规律。
也就是说,三中心四电子键可以被看作弱化的离子键,或者离子化的共价键。
我认为有些超价分子可以看作其他正常分子的等电子体,比如氯酸根离子(ClO₄⁻)、硫酸根离子(SO₄²⁻)、磷酸根离子(PO₄³⁻)、原硅酸根离子(SiO₄⁴⁻)、原碳酸根离子(CO₄⁴⁻),可以看作四氟化硅(SiF₄)的等电子体,这些阴离子都有着如同四氟化硅的正四面体结构,且不存在双键。
硝酸根离子(NO₃⁻)、偏磷酸根离子(PO₃⁻)、偏硅酸根离子(SiO₃²⁻)、碳酸根离子(CO₃²⁻),都可以看作三氟化硼的等电子体,存在四中心六电子大ピー键(∏₄⁶),也就是イコライカ芳香性,从而稳定其存在。
六氟化硫可以看作6个氟离子(F⁻)与1个S⁶⁺形成的特殊配合物结构;
氟氢根离子(HF₂⁻)可以看成二个氟离子与一个氢离子形成的配合物,任何氢键都可以看作氢形成的配合物。氢的配位数一般为2,有时候会变成3(分叉氢键)。
本质上,超价分子中的三中心四电子键(∑₃⁴),也叫三中心四电子シコマ键,其应该属于配位键,因为三中心四电子シコマ键只能出现于得电子性相关大于某个数值的二组元素之间,比如硫与氟、硫与氯、氢与氢,这也是为什么配位化合物大多呈现正方形的样子。比如酞菁铜中间的铜离子形成的配位键也应该属于三中心四电子键,并且三中心四电子键会具有更高的稳定性。
在高压下,氮、氧甚至氟都可以变成金属形态,钠先是变成电子盐形态,之后随着压强的增大也会变成金属形态,白矮星中的碳、氮、氧、铁都是超隅体,这意味着八隅律仅仅是普通物质的个例。
硫酸盐,由硫酸根离子(SO₄²⁻)与其它阳离子组成的化合物,大多属于电解质,且大多数溶于水。硫酸锶、硫酸钡、硫酸铅、硫酸亚铕(EuSO₄)难溶于水;硫酸亚镱(YbSO₄)、硫酸银、硫酸钙微溶于水。硫酸铅会与醋酸生成可溶于水但更加难以电离的醋酸铅,由于其生成物更加难以电离,所以使得反应能够发生。
硫酸根离子SO₄²⁻可以看作由四个氧离子O²⁻与一个S⁶⁺形成的配合物,其中硫是配位中心,氧是配体,硫酸钙Ca[SO₄]中的硫酸根离子[SO₄]²⁻是内界,钙离子Ca²⁺是外界。
硫酸根离子亦可以被看作S²⁺与4个O⁻通过4个S–O单键形成的离子,所以硫酸根离子有着与四氟化硅相同的结构。
另外,铵根离子可以被看作氨与氢离子形成的配合物,[NH₄]⁺中的氨NH₃是配体,氢离子H⁺是配位中心,由于铵根离子是甲烷的等电子体,所以铵根离子NH₄⁺、硼氢阴离子BH₄⁻都有着等同于甲烷的结构。
亚硫酸根离子SO₃²⁻可以被看作一个S⁴⁺与三个O²⁻形成的配合物,也可以看作1个S⁺与3个O⁻形成的负电共价化合物。亚硫酸根离子SO₃²⁻、三氧化氙分子XeO₃有着三氯化磷形式的成键。
其中,三氧化氙可以被看作Xe³⁺与3个O⁻通过三条共价键形成的内盐形极性分子。
亚硫酸盐的氧化可以被看作S⁴⁺被氧原子夺走2个电子的反应,所以有:
SO₃²⁻+O ══ SO₄²⁻
2SO₃²⁻+O₂ ══ 2SO₄²⁻
二氧化碳存在二个相互垂直的三中心四电子大ピー键(∏₃⁴),氧气存在二个相互垂直的二中心三电子大ピー键(∏₂³)。
臭氧存在类似于羧基阴离子(–CO₂⁻)、硝基(–NO₂)的弯曲形三中心四电子大ピー键(∏₃⁴)。臭氧有可能形成配位键(R←O₃)。 硝基是羧基的等电子体,硝基有着与羧基相同的结构。
臭氧(O₃)、亚硝酸根离子(NO₂⁻)可以看作是亚碳酸根离子(CO₂²⁻)的等电子体,也是存在弯曲形三中心四电子大ピー键(∏₃⁴)。
硫酸根离子的结构如同四氧化氙(XeO₄)、高氯酸根离子(ClO₄⁻)、磷酸根离子(PO₄³⁻)、原硝酸根离子(NO₄³⁻)、原硅酸根离子(SiO₄⁴⁻)、原碳酸根离子(CO₄⁴⁻)、四氟化硅(SiF₄),也就是高氯酸根离子、硫酸根离子、磷酸根离子、原硅酸根离子、原碳酸根离子都是四氟化硅的等电子体,有着如同四氟化硅的成键,所以不存在任何实际上的双键。
四氧化氙XeO₄可以看作1个Xe⁴⁺与4个O⁻形成4个单键的分子,除此之外四氧化钌、四氧化锇也有这样的结构,且键角皆为2arcsin(
高氯酸根离子ClO₄⁻可以看作1个Cl³⁺与4个O⁻形成4个单键的离子;
硫酸根离子SO₄²⁻可以看作1个S²⁺与4个O⁻形成4个单键的离子;
磷酸根离子PO₄³⁻可以看作1个P⁺与4个O⁻形成4个单键的离子。
原硝酸根离子NO₄³⁻可以看作1个N⁺与4个O⁻形成4个单键的离子。
这篇文章中的疏漏被주명원更正了
大家好,我是大老李。今天聊的一个问题是大老李小时候就知道的一个历史十分悠久的猜想,而它终于在历时400多年后,于在2017年被宣告正式解决。我想了下小时候比较出名猜想中,到现在能被解决的大概仅此一个。庞加莱(ポㇴカレ)猜想和5边型单密铺问题也算,但都没有今天这个问题出名,这个问题就是:开普勒猜想。
开普勒猜想最早出现在1611年,德国天文学家兼数学家开普勒(ケㇷ゚ロー, Kepler)写的一本科普小册子里:论六角形的雪花(On the six__cornered snowflake)里。这个开普勒现在最出名的当然是开普勒行星运动三大定律,但他看来是天文、地理都爱好,他也研究过雪花的形状,所以写了这本关于雪花的小册子。
在这本小册子里,开普勒提到了他与英国数学家托马斯‧哈利欧特曾有过通信,通信中他们曾经讨论过当时英国著名冒险家沃尔特·雷利(Sir Walter Raleigh)提出的一个问题:怎么堆放加农炮弹最有效率?
这个雷利是当是非常出名的冒险家,也博学多才,帮英国开拓了不少美洲的殖民地。作为一个船长,他当然也关加农炮单怎么堆方的问题。当时的加农炮弹大家电影里都看到过,都是一个个大铁球。在船上狭小的空间内,我们当然希望加农炮弹堆的密度越大越好。用稍微数学语言来表达就是:在一定的空间内,填充相同大小的小球,怎样的填充方式可以使填充密度最大?
沃尔特·雷利爵士(Sir Walter Raleigh,1552年~1618年10月29日),英国伊丽莎白时代著名的冒险家。同时也是位作家、诗人、军人、政治家,更以艺术、文化及科学研究的保护者闻名。
这个问题一听你就会想:这还不容易吗?随便去找一个卖水果的摊位,看看老板怎么堆苹果或橘子的?虽然你不一定能在脑子里想清楚具体的对法,但你直觉里能感觉到水果店老板的堆法就是最优的。 水果店老板最在意“球体填充”问题
这里我很推荐如果你家里有很多乒乓球或网球的话赶紧找出来试试看,相信你很快能还原水果店老板的堆法。如果你稍微尝试一下,你会发现实际上有两种堆法,按层从下到上来看:第一层肯定是所有小球挤在一起,每个球周围贴近6个球。上面一层每个球都放在底层球构成的“凹陷”当中,而且你会发现第二層所有球还是与6个球相贴,所以你会很满意这种堆法。第三层你当然还是会把球放在第二层球留下的凹陷当中,但你会发现有一种方法会使第三层的球与第一层完全对齐,这个堆放呈现ABABAB这种循环模式,也就是六方最密堆积。第三层还有一种摆法可以与第一层有所错位,但此时第4层又会与第一层对齐,所以此时会有ABCABC这种循环模式,也就是面心最密堆积。
数学里,把第一种ABAB循环的摆法称为:“六方最密填充“(hexagonal close packing),而ABCABC这种模式称为“面心立方填充”(face__centered cubic)。据说水果店老板经常用六方最密,而水兵堆炮弹经常使用面心立方堆积。那这两种堆法那种密度更大?其实你稍微观察看,找出堆法的重复模式,计算结果是一样的,具体数字是π÷√18,约等于0.740480489693,十二进制是0;8∗7672∗89911。
形象的说,就是给你一个够大的盒子和很多同样的小球,你在盒子里再怎么装小球,你也只能填满盒子约74%的空间,所以这个问题也被称为:球体填充问题(sphere packing)。
一般人都会觉得那两种填充法怎么看都是最佳了,但数学家是一群“杠精”:没有证明就不能称为结论。所以开普勒在这本1611年的小册子里提出了这个球体填充问题,并且猜想面心立方堆积就是最佳填充,这个猜想史称:开普勒猜想。
1611年那可是很早的时间啊,30年后牛顿才出生。但这个问题要经过笛卡尔、牛顿、莱布尼茨、伯努利家族、欧拉这些大牛的时代之后,到1831高斯才有一个突破,高斯证明了:六方最密堆积或者面心立方填充是周期性、有规律填充的方法中,密度最大的两种方法。
你一听可能又说:那不就完成了,难道不规则的填充密度可以更大?确实,直觉里当然会认为一样的小球,有规律的堆放要比不规则的堆放效率好,但是你怎么证明呢?而且有些例子下,不规则的填充确实比规则填充好。比如有这么道智力题:有一个边长为10的正方形,问你这个正方形里最多可以放进去多少个直径为1的圆?
你的第一反应答案当然是100个。但是你若仔细想想,如果我第一排放10个圆,第二排的圆都塞进第一排的两个圆之间的空隙呢?虽然宽度会浪费点,但是高度能节省点。如果这样摆,最后高度能省出一排的空间,那不是可能多放一点?这样一想问题一下子麻烦起来。你若有兴趣可以自己在纸上画画看,我可以告诉你正确答案是106,确实不规则的摆法比规则摆法更优,而更麻烦的其实是如何证明106就是最大。
又比如,在二维空间,正六边形网格(蜂巢)是使用最少的总周长将该表面划分成面积相等的区域的最佳方法。在三维中,使用最少的总面积将该空间划分成体积相等的区域的最佳方法则是韦尔__费伦结构(Weaire__Phelan bubbles),反而不是克尔文结构(截角八面体堆砌)。不过在工艺比较粗糙或者其他因素干扰的时候,或者考虑抗震性的时候,也可以使用受力更加均匀对称的截角八面体堆砌。
正因为有以上这种例子,所以高斯证明完之后,谁也不敢说问题解决了,人们还需等待排除不规则填充的情况(比如准晶体、非晶体)。后来希尔伯特还把它列入他著名的的20世纪23个重大数学问题中的第18个。
1953年,匈牙利数学家费耶斯·托特 (László Fejes Tóth)提出了一个解决开普勒猜想的思路。这个思路是这样,假设有一种不规则填充,可以使得密度大于面心立方填充,那么不管这种不规则填充是什么样,填充完成的空间里,至少有一个局部区域,这个区域中的密度会大于面心立方填充。
而他设计了一种方法,使得只要考察有限多种局部填充结构构,如果完整考察完这有限多种局部填充结构,且密度都低于面心立方,那么开普勒猜想就被解决的。但是他发现需要考察的局部结构数量太多了,1953年绝没有一种计算机可以处理的过来,人力更不可及。
费耶斯·托特,12 March 1915 ~– Budapest, 17 March 2005
到1992年,时年34岁,在密歇根大学任教的托马斯·黑尔斯(Thomas Hales)认为时机成熟,他决定循着托特的建议使用计算机来证明开普勒猜想,他找到了他的一个学生弗格森做他的助手。黑尔斯先是经过一些简化工作,尽量减少需要考虑的局部构型。但即便简化后,还是有超过5000个局部构型需要考察,而对每一个构型,都需要进行一次“线性规划”运算。线性规划是一种对很多变量的线性方程考察极值的一种方法,这种方法的计算量是很大的。黑尔斯面临的是大约10万次的线性规划求解。
托马斯·黑尔斯在演示球体填充问题,拍摄于1990年代。
所以,即便使用了计算机,他们也用了整整6年时间,才宣告计算完成,最终产生了3G的计算数据和200页的相关程序说明。黑尔斯的这个证明是很不寻常的,这是继四色定理之后,又一个主要靠计算机完成的数学证明。
当时权威期刊”数学年刊“(Annals of Mathematics)成立了一个12人的论文评议小组,组长是老托特的儿子(老托特当年还健在,84岁)。评议小组一致同意在数学年刊上登载这篇论文。又过了4年,到2003年,评议小组给出的最终结论是:他们有99%的把握,这个证明是正确的,剩下的1%,就是他们没法100%确定电脑程序没有bug,运行过程中也没有出现错误等等。这也是数学家怕了,四色定理被宣布证明之后就有一些争议,所以数学家对计算机的证明显得格外谨慎。
黑尔斯为了弥补这最后的1%,想了一个新的办法,这个办法就是把他的证明“形式化”,这样就可以用一些现成的软件工具去验证这个“形式化”的证明,这种软件就要“自动证明检查”(automated proof checking)软件。什么叫形式化的证明呢?有一种数学流派就叫形式主义,形式主义认为,数学的命题可以完全脱离其实际指代的对象而存在,而那些证明仍然是成立的。
借用希尔伯特曾经打过的一个比喻:比如欧几里得几何里有5大公设,过两点有且仅有一条直线,任意线段、射线都能延伸成一直线等等。希尔伯特说,如果你把5大公设里的点、线、面,等等都替换成任何其他符号或者名词,欧几里得几何还是成立的。比如,你说:“过两个十字路口有且仅有一条马路”,“任意筷子、算筹都能延伸成一条马路”“以任意十字路口为心及任意的跬步可以建造围栏”“凡十字架皆彼此相等”“过马路外的一个十字路口,有且只有一条骈行马路”等等。如此把五大公设这样重写一遍,是不影响后面的推理的,照样可以推出勾股定理【三条十字架组成的筷子组,满足斜筷子的平方等于十字架上两个筷子的平方和,也就是因为イ²且ロ²,所以ハ²】,乃至整个欧式几何。
对于黎曼几何,其第五公设是【过马路外的一个十字路口,没有一条骈行马路】,从而相当于对地球表面的描述,也就是相当于地球上的两条经线必定相交于南北极。第一公设则会改为【过两个不处于对趾点的十字路口,有且仅有一条马路;处于对趾点的两个十字路口,可以作无穷多条马路】。
对于双曲面几何,则是【过马路外的一个十字路口,至少有二条骈行马路】
士大夫评论 原文作“过两个桌子有且仅有一张床”,“任意筷子都能延伸成一张床”。但是这种表述已被士大夫改成更加形象的表述了。 对于纬线,只有赤道是【直线】(测地线),其他的纬线则是【曲线】。
不管你认不认可希尔伯特的说法,反正这种对数学的看法自成一派,称为形式主义。形式主义的数学证明在后来有一个意外的好处就是:机器可以读懂这种证明。比如你让计算机直接去读勾股定理的证明,计算机肯定看不懂;但如果你输入的是类似:【因为a²且b²,所以c²】或者【因为イ²且ロ²,所以ハ²】之类的语句,并将其转化为机器语言,机器就能看懂了,而且机器甚至于可以检验你的推理过程是否正确!因为机器完全不用管【a,b,c】【イ,ロ,ハ】到底是啥,机器只要根据我们事先输入的规则,逐步检验推理过程是否符合规则即可。
2000年前后,已经有一系列自动证明验证软件发明出来了,黑尔斯从2003年启动一个开源群体协作软件项目flyspeck (F代表Formal/形式化,S代表Sphere/球体,peck代表pack/填充),其想法就是把他的证明重新改写成形式化的证明,交由自动证明软件检查。但是把一个人能看懂的证明改写成机器能看懂的形式化证明是一件极其冗长和枯燥的过程。如果你去看看形式化证明,都是一些如同软件代码一样的东西。黑尔斯在启动项目时就预估,这个项目要完成大概需要20年!
形式化证明的代码,摘自FlySpech项目
但好在最近几年软件协作方面有了很好的网站github,很多人志愿加入这个项目,flyspeck项目最终于2014年8月10日正式宣布完成,用时约11年。2015年,黑尔斯和21个协作者提交了最终形式化证明开普勒猜想的论文,2017年5月,这个证明最终被评议通过。至此,开普勒猜想,经过406年的时间,终于告别猜想的帽子,成为一个定理!而黑尔斯也从34岁,熬到59岁,完成了他个人数学研究的一个重大使命。
三维空间的开普勒猜想解决了,数学家当然也考虑过其他维度的球体填充问题。一个有趣的问题是:维度越多,你觉得球体填充密度是越大还是越小?我的直觉是越大,因为感觉维度越多,球体可以互相靠近的方向越多,所以可以塞的越满嘛,但是恰恰相反,维度越多,球体填充密度就会越来越低,而且无限趋向于0 。
1维到3维的填充密度比较,是逐步递减过程。
原因的话可以从两方面体会,一个是你可以体会下平面上用圆填充是不是会比盒子里用球填充更密一点?
另一方面,有个有关高维度空间中物体的性质就是:维度越高,其中的物体的体积就越集中在物体的“外壳”或叫边界上。体积越靠近外壳,小球虽然挤在一起,看上去很多,但它们包裹住的体积占总体积比例是很小的。总之高维空间是很奇怪的空间,四维空间里的水果店老板会很郁闷,看上去来了一个大箱苹果,但是里面真正苹果所占体积却很小。
那高维空间的球体是否可以参考三维的对称性的填充方法,自然推广出去呢?结果完全不行,目前对3维以上的球体填充问题,人们只得到一些填充密度的下限和上限,没有完全能确定的,但是除去两个维度:8维和24维。8维和24维空间的最佳填充方案已经找到了。
听到这里,你是否感觉这两个维度数字似曾相识?对了!大老李之前的一期有关“有限单群分类定理”的节目中,几乎说过同样的话,那就是关于“亲吻数问题”,也可以叫【配位数问题】。亲吻数问题是问:一个球体,最多可以与多少个同样大小的其他球体相切?亲吻数或者配位数问你一听就会发现与球体填充问题非常相关,因为如果要使球体填充的足够紧密,尽可能使一个球与其他很多球相接触感觉是不错的。
三维空间内一个球最多与12个同样的球相切,因此3维的的亲吻数(配位数)是12。
亲吻数问题,或者配位数问题,目前4维空间以上情况,只对8维和24维空间有了确切的结果。它们是由英国数学家约翰·利奇(John Leech)在1960年代确定,并把那种结构称为利奇晶格。而利用这两个结果推广到球体填充问题,则要等到2016年,才由乌克兰女数学家 Maryna Sergiivna Viazovska (获得了2022年菲尔兹奖)解决。如前所述,高维空间的最密填充密度是很低的,8维约是25%,24维只有0.1%左右,高维空间真是怪异得深不可测! 乌克兰数学家:马林娜·谢尔吉夫娜·维亚佐夫斯卡(Maryna Sergiivna Viazovska,1984年12月2日~)
差不多讲完了开普勒猜想的全部历史,你可能问一个几乎对我每一期节目都会有人问的问题:研究这个有用吗?我得承认很多数学问题目前真的是没用的,但不妨碍我们去研究。而这个球体最密填充问题的的确确是有用的。比如原子结构中,就有很多原子之间可以呈现如同面心立方中的晶体结构,比如金属铜中的铜原子连接结构是面心立方堆积。
另一个应用领域是信息学中的纠错机制。如果一种信息由三个变量组成,那我们可以把这种信息看作三维空间中的一个个小球。我们希望传送这种信息的时候尽量密度大点,但是我们不能让信息之间靠太近,信息互相之间有重叠我们可能就无法区分信息。这个最密填充就能告诉我们信息传输的最大密度是多少,如果有误差该如何纠错。
在多维向量空间,则这些信息或信号变成了多维空间中的超球体。这时,多维空间中的超球体的最密堆积变得有用了。
看完开普勒猜想的历史,我最大的感慨是一个看似理所当然的结论,数学家花了400年才最终证明完成。而高维空间的情况下也许有更多意外等待着人类去发现 !