化学元素的提取方法 - johanzumimvon/Johan-zumimvon-Christianity GitHub Wiki
化学元素的提取方法整合修正版
神奇的化学反应
MgSO₄ + 2NaOH ══ Mg(OH)₂↓+ Na₂SO₄
Sr(OH)₂ + CO₂ ══ SrCO₃↓+ H₂O
士大夫评论
有三个反应,也是全都生成难溶性物质或者弱电解质(为了实验者和工人的安全,此处使用锶而不使用毒金属钡):
MgSO₄ + Sr(OH)₂ ══ Mg(OH)₂↓+ SrSO₄↓
CuSO₄ + Sr(OH)₂ ══ Cu(OH)₂↓+ SrSO₄↓
H₂SO₄ + Sr(OH)₂ ══ SrSO₄↓+ 2H₂O
这可能用于污水处理中。
1,氢元素 H ヒ与ドロゲニュㇺ
电解氢氧化钠的水溶液可以得到氢元素与氧元素,氢氧化钠可以增强水的导电性:
2H₂O ══(通电) 2H₂↑+O₂
热解烃类可以得到碳黑与氢元素:
C₃H₈ ══△ 3C(ロ)↓ +4H₂
最终得到的氢元素以氢气形态存在。
除此之外,水煤气法、水与一氧化碳反应也能得到氢气,但由于其属于可逆反应(可逭反应),所以其纯度不高。
重氢分离可以使用液态氢分馏法,因为氢的沸点是20.28K,氘的沸点是23.65K,那么氢氘的沸点是21.90K(几何平均数),先得到高纯度的HD(氢氘),并剩下纯度更高的H₂,也就是去氘氢,之后让HD与金属钠反应得到氢化钠与氘化钠:
2Na + HD ══ NaH + NaD
加热到300℃(573K),发生反应:
2NaH ══△ 2Na + H₂↑
2NaD ══△ 2Na + D₂↑
虽然这个过程会有一半的HD副产物产生,但通过分馏可以得到纯净的D₂。副产物则会进入之前的生产过程。
氘 | deuterium | 伝ューテリュㇺ
去氘氢(purely protium,purotium,プロテュム)则可以用于其他核素的精炼,比如¹¹B、¹²C、¹⁸O、²⁸Si、³⁷Cl、⁷⁹Br等等。
2,氦元素 He ヘーリュㇺ
氦元素存在于天然气中,氦元素可以通过液态天然气的分馏得到。这是因为氦的沸点最低。
氦三核素(³He)可以通过加热月球土壤的方法得到。因为月球土壤吸收了大量来自太阳风的³He。
将月球土壤粉碎,通过加热月球土壤得到的³He,其中混杂有氢气(H₂)、氢氘(HD)、氘气(D₂)、氦四(⁴He)、二氧化碳(CO₂)、氮气(N₂)、氧气(O₂)、氖(Ne)、氩(Ar)等等杂质,被称为麤³He。根据其沸点的不同,经过精馏可以得到精制³He,可用于核聚变能源。
氦三自身就可以聚变产生氦四,这样就会省去氘的消耗,因为宇宙中,氘远远少于氦三:
2³He → ⁴He + 2H
³He + D → ⁴He + H
3,锂元素 Li リ水ュㇺ
锂辉石和硫酸钾一起烧结,钾将锂置换出来,形成可溶于水的硫酸锂。
2LiAl(SiO₃)₂ + K₂SO₄ ══ Li₂SO₄ + 2KAl(SiO₃)₂
在很长一段时期内,硫酸盐分解法是工业制备锂的唯一方法。此方法不仅适用于锂辉石,也可用来处理锂云母。
氢氧化锂的制备方法
Li₂SO₄ + Na₂CO₃ ══ Li₂CO₃↓+ Na₂SO₄
过量的碳酸钠可以促进碳酸锂的沉淀完全。
Li₂CO₃ + Ca(OH)₂ ══ 2LiOH + CaCO₃
生成了溶解度更小的沉淀
也可以通过氢氧化锶得到氢氧化锂
Li₂SO₄ + Sr(OH)₂ ══ SrSO₄↓+ 2LiOH
4,铍 Be ベーリ与リュㇺ
铍是剧毒元素,强烈的毒金属,如果真的需要铍,则可以从哈萨克斯坦(カチャㇰㇲタㇴ,قازاقستان,Қазақстан)或者美国(アメリカ)这样的反对共产主义的国家购买,铍的使用、报废需要小心。
不变钢(因瓦合金、殷瓦钢、invar、イㇴワー,Fe₇₁Ni₃₈)则可以从反对共产主义的法国购买!
anything but commie china!
anycolor but reds!
铍在高温下对氧有很强的亲和力,在去除表面氧化层后则会对水进行还原反应,因此从化合物中萃取出铍并不容易。只有美国(アメリカ)、中国和哈萨克斯坦(カチャㇰㇲタㇴ)有大规模的铍萃取工业。
铍的生产
德古萨工艺
德古萨工艺适合于处理含铍较高的绿柱石矿物。由于绿柱石不能直接被硫酸酸解,必须加入碱熔剂或经热处理改变其晶型或结构,增加反应活性后才能被酸解,其反应为:
[3BeO+Al₂O₃+6SiO₂] + 2CaO ══△ [CaO+Al₂O₃+2SiO₂] + [CaO+3BeO+2SiO₂] + 2SiO₂
加入的熔剂可以为碱性氧化物如纯碱、石灰等,也可以为氯化物如氯化钙、 氯化钠等。其中,石灰具有价格与环保优势,焙烧时的配料比m(石灰):m(绿柱石) 控制为1~3,焙烧温度一般为1400℃~1500℃。之后使用酸解工艺:
[CaO+3BeO+2SiO₂] + 4H₂SO₄ ══ CaSO₄ + 3BeSO₄ + 4H₂O + 2SiO₂
浸出液中含铁、铝等杂质,经浓缩后,添加硫酸铵,再冷却结晶,铁、铝形成硫酸亚铁铵和硫酸铝铵矾渣,液固分离后得到含铍的除铝液,过程主要反应如下:
Fe²⁺ + 2NH₄⁺ + 2SO₄²⁻ ══ (NH₄)₂Fe(SO₄)₂
Al³⁺ + NH₄⁺ + 2SO₄²⁻ ══ NH₄Al(SO₄)₂
往除铝液中加入氧化剂,以氨水作中和剂,用乙酸钠缓冲液,调节pH值为5左右沉淀铝、铁,其反应如下:
Fe³⁺ + 3OH⁻ ══ Fe(OH)₃↓
Al³⁺ + 3OH⁻ ══ Al(OH)₃↓
液固分离后得到含铍的中和液。用氨水调节中和液至接近中性,氢氧化铍即从溶液中完全沉淀,所含的少量杂质铝可通过过量氨水碱洗进一步分离,其反应如下:
BeSO₄ + 2NH₃ + 2H₂O ══ Be(OH)₂↓+ (NH₄)₂SO₄
Al(OH)₃ + NH₃ + H₂O ══ NH₄[Al(OH)₄]
加热氢氧化铍得氧化铍
Be(OH)₂ ══△ BeO + H₂O↑
氟化法
氟化法建立于铍氟酸钠能溶于水,而冰晶石不溶于水的原理之上。将绿晶石与硅氟酸钠混合,烧结2小时于750℃(1023K),烧结块经湿磨至粒径为0.074mm,室温下用水三次浸出,其主要反应如下:
[3BeO+Al₂O₃+6SiO₂] + Na₂CO₃ + 2Na₂SiF₆ ══ 3Na₂BeF₄ + 8SiO₂ + Al₂O₃ + CO₂↑
氟化法获得的浸出液的纯度高要远远高于硫酸法,不需要专门的净化处理就可以直接用适量氢氧化钠沉淀出氢氧化铍,其反应为:
Na₂BeF₄ + 2NaOH ══ Be(OH)₂↓+4NaF
用四氟化硅回收氟化钠
2NaF + SiF₄ ══ Na₂SiF₆
氟化法的流程比较简单,防腐蚀条件好,并且还适合处理含氟高的原料,但产品质量稍逊于硫酸法。但该法处理低品位矿时,除辅助剂耗量增加外,钙和磷的增加将降低烧结料中水溶铍的含量,影响回收率,且三废处理时还带来氟处理的问题。
ブルス゚工艺
ブルス゚直接将绿柱石在电弧炉中加热到1700℃熔化, 然后倾入高速流动的冷水中, 得到玻璃状的绿柱石,再在煤气炉中加热至900℃ 使氧化铍析出, 粉碎后与 93%的硫酸混合成浆状,将料浆酸解于 250℃~300℃(523K~573K), 矿石中铍的浸出率可以达到93%~95%, 过程的主要反应如下:
3BeO + Al₂O₃ + 6H₂SO₄ ══ 3BeSO₄ + Al₂(SO₄)₃ + 6H₂O
5,硼元素 B ボーラーキュㇺ
水溶性硼矿的加工方法
天然硼砂矿的精制
将天然硼砂矿破碎,用水溶解,再经过滤、结晶、分离、干燥即得五水硼砂和十水硼砂。
从盐湖卤水中提取硼酸
将含硼酸盐约1%的卤水用多元醇一煤油组成的有机相萃取硼酸,然后用稀硫酸反萃取,反萃取液经蒸发、结晶、离心分离、干燥处理即得硼酸成品。
水不溶性硼矿的加工方法
从水不溶性硼矿制取硼酸的方法主要有酸法、碱法和碳酸铵法。
酸法
适于含硼高的富矿。浸出剂可用硫酸、盐酸、硝酸,浸出多在常压下进行,浸出方式有间歇式和连续式二种。将粉碎至约0.125mm的硼矿粉,放在装有水的耐酸反应器中,慢慢加酸酸解。
反应式为:
[MgO+B₂O₃]+H₂SO₄+2H₂O ══ 2H₃BO₃+MgSO₄
生成的硼酸与硫酸镁不易分离,工业上采用蒸馏或萃取法使它们分开。
碱法
既适用于处理富硼矿,也适用于处理贫硼矿。这是中国首先研究成功的方法,碱解剂有氢氧化钠和碳酸钠,有加压碱解法、碳酸钠法和多硼酸钠法之分。加压碱解法收率高,反应时间短,但工艺流程较长。873K~1073K的温度下,先将块状硼矿石放在窑内煅烧脱水。煅烧产物经粉碎至约0.125mm,在混料罐内与过量碱混合,再送入带有搅拌的碱解器内,在413K温度和4MPa压力下进行反应:
[MgO+B₂O₃]+2NaOH ══△ 2NaBO₂ + MgO + H₂O↑
4NaBO₂ + CO₂ ══ Na₂B₄O₇ + Na₂CO₃
回收碳酸钠
Na₂CO₃+Ca(OH)₂ ══ 2NaOH+CaCO₃
总反应式为
2[MgO+B₂O₃]+2NaOH + Ca(OH)₂ + CO₂ ══△ Na₂B₄O₇ + CaCO₃ + 2MgO + 2H₂O
该反应可以改进为:
将硼矿石、氢氧化钠、氢氧化钙混合加热脱水,之后通入高压二氧化碳带走水分,得到硼酸钠。
反应结束后,经过滤、结晶、分离、干燥处理后得硼砂,含纯碱母液经苛化后返回使用。
碳碱法与加压碱法不同之处在于碱解与碳化合并于压煮器中进行,纯碱也不需提纯即可循环使用。多硼酸钠法的加碱量低于理论量,因而生成多硼酸钠时碱耗较低,但不能直接得到硼砂。
单质硼的提取
业上有4种制取元素硼的方法,它们是卤化物氢还原法、金属热还原法、熔盐电解法和热分解法。
卤化物氢还原法
使氢和三氯化硼的混合气流在热的钽丝上分解沉积出晶形硼,反应为:
2BCl₃ + 3H₂ ══ 2B + 6HCl
此法可得到纯度高达99.999%的高纯硼。或者可以用氢和三溴化硼的混合气体经过钽丝,电热到1500K,三溴化硼在高温下被氢还原,生成的硼在钽丝上成片状或针状结构。
电解法
电解熔融的KBF₄或者掺入盐类的三氯化硼,可以得到更纯的硼:
2KBF₄ + 6KCl ══(通电) 8KF + 2B + 3Cl₂↑
制备三氯化硼:
B₂O₃ + 3C + 3Cl₂ ══ 2BCl₃ + 3CO
2BF₃ + Al₂Cl₆ ══ 2BCl₃ + 2AlF₃(实验室)
电解:
2BCl₃ ══(通电,使用KBF₄+KCl) 2B + 3Cl₂↑
金属热还原法
原料有硼酸、硼氧化物、氟硼酸盐、氢硼化物,还原剂可采用金属锂、钠、镁、铝、钾、钙、铁、锌。较多采用镁还原硼酸,其反应为:
2H₃BO₃ ══△ B₂O₃ + 3H₂O↑
B₂O₃ + 3Mg ══ 2B + 3MgO
热分解法
还原原料限于卤硼化物和氢硼化物,如溴化硼、碘化硼、乙硼烷等,分解温度在1073~1773K。此法可获较高纯度的硼。
工业上单质硼的制备
工业上制备有二种方法:
酸法
酸法是直接用过量浓硫酸酸解硼镁矿,生成硼酸沉淀,过滤分离,加热分解得到B₂O₃,再用镁还原得到单质硼。
此方法虽简单,但须耐酸设备,不如碱法好。
碱法
イ,用浓碱液碱解硼镁矿得偏硼酸钠:
Mg₂B₂H₂O₆ + 2NaOH +4H₂O ══ 2Na[B(OH)₄] + 2Mg(OH)₂
ロ,将Na[B(OH)₄]在强碱溶液中结晶出来,使之溶于水成为较浓的溶液,通入CO₂调节碱度,浓缩结晶即得到四硼酸钠,即硼砂:
4Na[B(OH)₄]+CO₂ ══ Na₂B₄O₇+Na₂CO₃+8H₂O
ハ,将硼砂溶于水,用硫酸调节酸度,可析出溶解度小的硼酸晶体:
Na₂B₄O₇ + H₂SO₄ + 5H₂O ══ 4H₃BO₃ + Na₂SO₄
ニ,加热使硼酸脱水生成B₂O₃ :
2H₃BO₃ ══△B₂O₃ + 3H₂O↑
ホ,用镁或铝还原B₂O₃得到粗硼:B₂O₃ + 3Mg ══ 2B + 3MgO。 粗硼的含量在95%~98%,需要再用NaOH, HCl等处理提纯。
高纯硼的制备:
硼纤维通常采用气相化学沉积法。将连续通入反应管的钨丝直接通电加热到1000℃~1200℃。在反应管中通入BCl₃和H₂的混合气体,在钨丝的表面引起反应,形成硼纤维:
2BCl₃ + 3H₂ ══ 2B + 6HCl
分解碘化硼:
2BI₃ ══△ 2B + 3I₂↑
硼的核素分离
通过去氘氢(purotium,プロテュム)可以得到去氘硼化氢,利用同位素效应造成的沸点差异,可以实现¹⁰B₂H₆、¹⁰B¹¹BH₆、¹¹B₂H₆的精馏分离。其中,¹¹B较难吸收中子,可用于航天设备的生产。连续精馏可以得到用于熄灭失控核反应堆的¹⁰B。
6,碳 カㇻボーニュㇺ
碳的同位素分离:
将甲烷通过精馏,其中¹²CH₄的沸点低于¹³CH₄的沸点,所以可以得到纯的¹²CH₄。
¹²CH₄ ══△ ¹²C(ロ) + 2H₂
可以得到纯¹²C核素构成的碳黑
¹²CH₄ + 2O₂ ══点燃 ¹²CO₂ + 2H₂O
剩下的¹³CH₄则可用于制取由纯碳十三核素构成的有机化合物,可用于碳核磁共振谱,由于其几乎是¹³CH₄,所以其灵敏度可以提高92倍,与氢的核磁共振谱、有机化合物的红外谱结合,可以大大缩短某些复杂的有机化合物结构的分析时间,也可以用于生物学实验、农学研究、幽门螺杆菌检验。
7,氮 ニㇳロゲニュㇺ
液化空气分馏可以得到高纯度的氮气、氧气、氖、氩、氪、氙。
如果要得到高纯度的¹⁴N,可以对氮气进行进一步的精馏,利用¹⁴N₂、¹⁴N¹⁵N、¹⁵N₂的沸点差异,可以得到纯度很高的¹⁴N₂。
如果要得到高纯度的¹⁵N,可以用氮气与去氘氢(プロテュム)反应,也就是
N₂ + 3H₂(プロテュム) ══△,催化剂 2NH₃(プロテュム)
对去氘氨进行精馏可实现¹⁴N与¹⁵N的分离。
强硝化剂五氧化二氮的制取方法
N₂O₄ + O₃ ══ N₂O₅ + O₂
8,氧 オㇰシ与ゲニュㇺ
液化空气分馏可以得到高纯度的氧气。
要想得到高纯度的¹⁶O,可以通过液态氧气的精馏实现。剩下的高沸点部分则可用于其他核素的分离。
要想得到高纯度的¹⁸O,可以通过以下反应得到:
¹²C的不完全燃烧
2 ¹²C + O₂ ══点燃 2 ¹²CO
¹²CO₂ + ¹²C ══△ 2 ¹²CO
通过对去除碳十三的一氧化碳进行分馏,可以得到高纯度的¹⁷O、¹⁸O核素,其中¹⁷O可用于有机化合物的核磁共振谱。
通过精馏¹H₂O(一氧化二プロテュム,也叫去氘水、贫氘水),也能实现¹⁷O、¹⁸O的分离。
9,氟 ㇷルオールㇺ
氟是单核素元素,只有¹⁹F是稳定的,其他的都是短命鬼。
氟化氢可以茧石与硫酸反应得到,该反应可以在铁制容器中进行:
CaF₂ + H₂SO₄ ══△ CaSO₄ + 2HF↑
在铁容器中,使用铁电极,电解氟氢酸钾(KHF₂)的氟化氢溶液,可以得到氟气,这也是ヘㇴリ·モアサㇴ(Henri Moissan)制取氟单质时的方法,尽管当时使用的是氟化钙容器:
2HF ══(通电,使用KHF₂) H₂↑ + F₂↑
铁可以被氟化氢、氟气钝化,产生三氟化铁,三氟化铁是致密的物质,可以紧紧地附着在铁表面,阻止进一步反应:
2Fe+6HF ══ 2FeF₃ + 3H₂↑
2Fe + 3F₂ ══ 2FeF₃
10,氖 ニューㇴ
其中霓虹灯仍然叫做ネオㇴ,为了不发生误解而将氖元素称为ニューㇴ。
氖是空气分馏的产物,含量少而价格高,氖通过进一步的精馏可以得到高纯度的²⁰Ne、²¹Ne、²²Ne。
11,钠 ナㇳリュㇺ
钠元素可以通过盐矿或者海边盐田得到。甘地(ガㇴ⿱一台,Gandhi)发明过煮海水制盐的方法。不过有趣的是,甘地是严格的印度教信徒,是引导印度摆脱英国束缚的重要人物,甘地不仅不吃葱蒜五辛烟酒肉,也不吃大豆、食盐等等看似平常的食物。
粗盐经过精炼可以得到高纯度的钠,如果使用Na[B(C₆H₅)₄],则可以得到纯度更高的含钠化合物。
粗盐的水溶液经过静置之后过滤,可以变得澄清。
这个过程,之所以不使用氯化钡,是因为钡离子半径很大,很容易形成稳定的配位化合物,使得钡元素时常表现出过渡元素的调子:
BaCO₃ + 2Na₂CO₃ ══ Na₄[Ba(CO₃)₃]
Ba + 8CO ══ [Ba(CO)₈]
BaSO₄ + 3Na₂CO₃ ══ Na₂SO₄ + Na₄[Ba(CO₃)₃]
过滤沉淀,嚮粗盐的水溶液中加入过量氯化锶,去除硫酸根离子:
Sr²⁺ + SO₄²⁻ ══ SrSO₄↓
如果对硫酸根离子的浓度要求不严的话,也可以使用过量氯化钙去除硫酸根离子:
Ca²⁺ + SO₄²⁻ ══ CaSO₄↓
之后过滤掉硫酸盐沉淀,加入过量碳酸钠,去除锶、钙:
Sr²⁺ + CO₃²⁻ ══ SrCO₃↓
Ca²⁺ + CO₃²⁻ ══ CaCO₃↓
之所以不使用钡元素,是因为钡元素经常表现出过渡元素的调调:
BaSO₄ + 3Na₂CO₃ ══ Na₂SO₄ + Na₄[Ba(CO₃)₃]
硫酸钡发生配位解,变成有毒的可溶性物质
过滤掉碳酸盐沉淀,加入氢氧化钠去除镁离子:
Mg²⁺ + 2OH⁻ ══ Mg(OH)₂↓
之后过滤掉沉淀,加入氯化氢并调到酸碱度为5.6(饱和碳酸溶液的酸碱度,也就是酸雨的临界值),可以发生反应:
H⁺ + OH⁻ ══ H₂O
2H⁺ + CO₃²⁻ ══ CO₂↑+ H₂O
最终可以得到含有少量氯化钾的高纯度氯化钠。
如果要得到不含钾的纯净氯化钠,可以加入过量的Na[B(C₆H₅)₄]的氢氧化钠溶液去除钾离子、铷离子、铯离子:
KCl + Na[B(C₆H₅)₄] ══ K[B(C₆H₅)₄]↓+ NaCl
RbCl + Na[B(C₆H₅)₄] ══ Rb[B(C₆H₅)₄]↓+ NaCl
CsCl + Na[B(C₆H₅)₄] ══ Cs[B(C₆H₅)₄]↓+ NaCl
使用氨水可以去除Na[B(C₆H₅)₄]:
Na[B(C₆H₅)₄] + NH₃ + H₂O ══ NH₄[B(C₆H₅)₄]↓+ NaOH
过滤沉淀后加入盐酸调至中性:
NaOH + HCl ══ NaCl + H₂O
NH₃ + HCl ══ NH₄Cl
蒸干溶液之后加热可以去除氯化铵:
NH₄Cl ══△ NH₃↑+ HCl↑
金属钠可由电解法得到
2NaCl ══通电 2Na + Cl₂
金属钠也可以通过电解熔融态的氢氧化钠得到,戴维(David,太エヰド,为了与圣经中的太ヰド区分开来而按英语发音使用太エヰド)就是通过电解熔融氢氧化钠得到金属钠的。
4NaOH ══通电 4Na + O₂↑+ 2H₂O↑
四苯基硼酸钠的制取方法:
C₆H₆ + Br₂ ══(ZrCl₄催化) C₆H₅Br + HBr↑
士大夫评论
酞菁绿就是酞菁铜的16个氢被氯完全取代的产物!也就是:
[CuPc] + 16Cl₂ ══(ZrCl₄催化) [CuPch] + 16HCl
Mg + C₆H₅Br ══ C₆H₅MgBr(格林试剂)
NaBF₄ + 4C₆H₅MgBr ══ Na[B(C₆H₅)₄] + 2MgBr₂ + 2MgF₂
小百科
钠盐也有难溶者,比如锑酸钠Na[Sb(OH)₆]就是一例。钠盐与臭氧或者次氯酸钠的联合使用可以用于含锑废水的处理:
Sb₂O₃ + 2O₃ + 5H₂O + 2NaOH ══ 2Na[Sb(OH)₆]↓+ 2O₂
12,镁 マ丆シュㇺ
イ,海水提取镁
海水的盐卤池中加入过量的氢氧化钙可以得到氢氧化镁
Mg²⁺ + 2OH⁻ ══ Mg(OH)₂↓
Mg(OH)₂ + 2HCl ══ MgCl₂ + 2H₂O
MgCl₂ ══△,通电 Mg↑ + Cl₂↑
ロ,菱镁矿法
MgCO₃ ══△MgO + CO₂↑
2MgO + C + 2Cl₂ ══△ 2MgCl₂ + CO₂
MgCl₂ ══△,通电 Mg↑ + Cl₂↑
电解镁过程中,用高温设备对镁蒸气进行分馏、管道扩散,可以实现²⁴Mg、²⁵Mg、²⁶Mg的分离。
13,铝 アルーミニュㇺ
被粉碎的铝土矿用水冲洗掉颗粒表面的粘土等杂质,经过碱解可得到氢氧化铝
Al₂O₃ + 2NaOH +3H₂O ══ 2Na[Al(OH)₄]
二氧化碳酸化沉淀
Na[Al(OH)₄] + CO₂ ══ NaHCO₃ + Al(OH)₃↓
加入过量酸去除硅
Na₂SiO₃ + H₂SO₄ ══ H₂SiO₃↓+ Na₂SO₄
2Al(OH)₃ + 3H₂SO₄ ══ Al₂(SO₄)₃ + 6H₂O
Al₂(SO₄)₃ + 6NaOH ══ 2Al(OH)₃↓+ 3Na₂SO₄
2Al(OH)₃ ══△Al₂O₃ + 3H₂O↑
电解精炼铝
2Al₂O₃ ══(△,Na₃AlF₆、CaF₂助熔) 4Al + 3O₂↑
14,硅
SiO₂ + 2C ══△Si + 2CO↑
为了避免碳化硅的生成,二氧化硅应该过量。
硅的精炼
Si + 2Cl₂ ══△ SiCl₄
SiCl₄ + 2H₂ ══△ Si + 4HCl
纯净硅化合物的生产
SiCl₄ + 8NaOH ══ Na₄SiO₄ + 4NaCl + 4H₂O
Na₄SiO₄ + 2CO₂ ══ 2Na₂CO₃ + SiO₂↓
玻璃的生产
SiO₂ + Na₂CO₃ ══△ Na₂SiO₃ + CO₂↑
SiO₂ + CaCO₃ ══△ CaSiO₃ + CO₂↑
La₂O₃ + 3SiO₂ ══△ La₂(SiO₃)₃
硅核素的分离
Si + 2 ³⁵Cl₂ ══ Si³⁵Cl₄
对Si³⁵Cl₄进行分馏、管道扩散可得到高纯度的²⁸Si、²⁹Si、³⁰Si。
15,磷 フーㇲフルㇲ
Ca₃(PO₄)₂ + 3SiO₂ ══△ 3CaSiO₃ + P₂O₅
P₂O₅ + 5C ══△ 2P + 5CO↑
磷酸可由磷矿与浓硫酸反应得到:
Ca₃(PO₄)₂ + 6H₂SO₄(浓) ══△ 3Ca(HSO₄)₂ + 2H₃PO₄
16,硫 スㇽフㇽ
4FeS₂ + 11O₂ ══ 2Fe₂O₃ + 8SO₂
S + O₂ ══ SO₂
2SO₂ + O₂ ══(V₂O₅催化) 2SO₃
士大夫评论
希望以后能够开发出三氧化钼催化生产硫酸的方法!
通过硫的还原、硫化氢的精馏可以实现硫的同位素分离
Na₂SO₄ + 2C ══△ Na₂S + 2CO₂↑
Na₂S + 2HCl(プロテュム) ══ H₂S(プロテュム)↑+ 2NaCl
将硫化氢精馏、管道扩散,可得到H₂³²S、H₂³³S、H₂³⁴S、H₂³⁶S
17,氯 キローリュㇺ
电解饱和精制食盐的水溶液可得到氯气
2NaCl +2H₂O ══通电,隔膜 2NaOH + H₂↑+ Cl₂↑
硫酸也可用于生产氯化氢:
2NaCl + H₂SO₄(纯) ══△ 2HCl↑+Na₂SO₄
通过去氘氢(プロテュム)与氯气反应,或者贫氘水与三氧化硫得到的浓硫酸与食盐反应,之后精馏可以实现H³⁵Cl与H³⁷Cl的分离。
H₂(プロテュム)+ Cl₂ ══点燃 2HCl(プロテュム)
SO₃ + H₂O(贫氘水) ══ H₂SO₄(プロテュム)
2NaCl + H₂SO₄(纯) ══△ 2HCl↑+Na₂SO₄
通过对HCl(プロテュム)进行精馏可得高纯度的³⁵Cl与³⁷Cl。
18,氩 アーㇻゴㇴ
液态空气经过分馏可得到高纯度的氩气,氩气经过精馏可得到高纯度的³⁶Ar(被认为可发生β⁺β⁺衰变)、³⁸Ar、⁴⁰Ar
19,钾 カリュㇺ
化合物钾可通过草木灰浸取液或者硝酸钾得到:
K₂CO₃ ══(浸取) K₂CO₃
4KNO₃ + 5C ══△ 2K₂CO₃ + 3CO₂↑+ 2N₂↑
K₂CO₃ + Ca(OH)₂ ══ 2KOH + CaCO₃
单质钾则通过以下反应得到
Na + KCl ══△ NaCl + K↑
通过对钾蒸气进行精馏,可实现³⁹K、⁴⁰K(☢️)、⁴¹K的分离。分离出来的⁴⁰K(☢️)有可能用于核电池,从而从一定程度上解决能源危机。
20,钙 カㇻキュㇺ
钙的精炼
900℃(1173K)时,石灰石热分解,碳酸锶稍有分解,碳酸钡不分解:
CaCO₃ ══△CaO + CO₂↑
CaO + H₂O ══ Ca(OH)₂
将氢氧化钙溶于大量的低温蒸馏水,可以实现氢氧化钙与其他杂质的分离。
金属钙的制取
铝法
6CaO + 2Al ══△ 3Ca + [3CaO+Al₂O₃]
电解法
高温下, 碳酸钙分解
CaCO₃ ══ CaO + CO₂↑
氧化钙水合生成熔点更低的氢氧化钙
CaO + H₂O ══ Ca(OH)₂
氢氧化钙在512℃(785K)的高温發生熔化, 变成熔融态, 加入氢氧化钠可降低氢氧化钙熔点, 通过钽电极可被电解:
2Ca(OH)₂ ══ 2Ca + O₂↑ + 2H₂O↑
金属钙可以用来还原多种化学元素:
2LaCl₃ + 3Ca ══ 2La + 3CaCl₂
2YmCl₃ + 3Ca ══ 2Ym + 3CaCl₂
2DyF₃ + 3Ca ══ 2Dy + 3CaF₂
对二水溴化钙进行分馏,有可能实现钙的核素分离。
钙的其他用途
⁴⁸Ca可通过双β衰变放出4.274MeV能量,相当于1千克⁴⁸Ca放出86000亿焦耳能量,是极好的核能源!
且⁴⁸Ca在高度禁戒的普通β衰变中也会释放出0.282MeV的能量,这意味着钙有可能成为环保核能源。
每535千克钙中含有1千克⁴⁸Ca。这意味着1千克碳酸钙可以提供大约64亿焦耳能量,足以煮沸8个大水池子的水。
钙虽然是主族元素,如果不是遇到依地酸、氨,在溶液中不表现过渡元素的调调,但是钙在极端情况下也会表现出过渡元素的调子,形成稳定且无毒的黄色颜料:
CaO + TaON ══△ CaTaNO₂
CaCO₃ + TaON ══△ CaTaNO₂ + CO₂↑
TaON可由Ta₂O₅氨化得到:
Ta₂O₅ + 2NH₃ ══△ 2TaON + 3H₂O
22,钛 丌ーターニュㇺ
用钠或者镁还原四氯化钛(TiCl₄)可以制取金属钛。还原作业在高温、惰性气体保护气氛中进行,还原产物主要采用真空蒸馏法分离出剩余的金属镁和MgCl₂,获得海绵状金属钛。
TiO₂ + 2Cl₂ + 2C ══△ TiCl₄ + 2CO
氧化铝、二氧化锆、二氧化铪也有这样的性质:
Al₂O₃ + 3Cl₂ + 3C ══△ Al₂Cl₆ +3CO
ZrO₂ + 2Cl₂ + 2C ══△ ZrCl₄ + 2CO
HfO₂ + 2Cl₂ + 2C ══△ HfCl₄ + 2CO
还原四氯化钛
4Na + TiCl₄ ══△ Ti + 4NaCl
2Mg + TiCl₄ ══△ Ti + 2MgCl₂
得到的海绵钛经过水洗、干燥、熔融可得金属钛。
分解四碘化钛可得高纯度金属钛
TiI₄ ══△ Ti + 2I₂↑
有人设想电解法制取金属钛
TiO₂ ══(△,电解,CaO助熔) Ti + O₂↑
23,钒 ワナ台ュㇺ
钒的分离
将含钒矿石碱熔可得到钒酸钠Na₃VO₄,同时伴有铬酸钠杂质Na₂CrO₄、钼酸钠杂质Na₂CrO₄。
加入氯化亚铁可以还原掉三价铬,之后通入氧气,加热溶液,去除掉过量的铁:
Na₂CrO₄ + 3FeCl₂ + 5H₂O ══ CrCl₃+ 3Fe(OH)₃↓+ 2NaCl + HCl
4FeCl₂ + O₂ + 10H₂O ══△ 4Fe(OH)₃↓+ 8HCl
调节溶液酸碱性直到中性,并过滤掉过量的氢氧化铁,之后加入过量氢氧化钠并移除铬:
CrCl₃ + 3NaOH ══ Cr(OH)₃↓+ 3NaCl
之后加入二氧化硫并加热,钼酸钠被还原成钼蓝,钨酸钠被还原成钨蓝,钒则会被还原为正三价这样就可以得到较为纯净的钒
纯的金属钒一般是用钾在高压下将五氧化二钒还原而得到的。大多数钒是其它矿物加工时的副产品。工业上也可以用铝,焦炭还原五氧化二钒生产纯钒。
钒提取技术介绍
酸浸碱溶提钒法
利用酸使含钒固废中的钒以VO₂⁺的形态浸出,加碱中和,在弱碱性限格下用氧化剂氧化其他价态的钒,使钒全部成为五价离子,比如VO₃⁻、VO₄³⁻,并使钒与铁的水合氧化物等杂质共同沉淀,再用酸碱浸制得粗钒,粗钒经碱溶生成五价钒的钠盐,并除去杂质硅,后用铵盐二次沉钒得偏钒酸铵,经焙烧得到高纯V₂O₅,该工艺已应用低钒钢渣提钒。
钠化焙烧提钒法
钠化焙烧提钒是含钒原料提钒应用较多的工艺,研究也较为透彻,中国陈厚生教授对该工艺技术贡献较大。其基本原理是:以食盐或苏打为添加剂,通过焙烧将多价态的钒转化为水溶性五价钒的钠盐,如Na₂O+イV₂O₅ 和NaVO₃,再对钠化焙烧产物直接水浸,可得到含钒及少量铝杂质的浸取液,然后加入铵盐(酸性铵盐沉淀法)制得偏钒酸铵沉淀,经焙烧得到粗 V₂O₅,再经碱溶、除杂并用铵盐二次沉钒得偏钒酸铵,焙烧后可得到纯度大于98%的V₂O₅。也可用硫酸浸渍焙烧产物,此时发生反应:
2NaVO₃+H₂SO₄ ══ Na₂SO₄+H₂O+V₂O₅
分离得到粗V₂O₅,后经碱溶、除杂并用铵盐二次沉钒得偏钒酸铵,经焙烧可得高纯V₂O₅。该工艺已用于石煤和低钒钢渣提钒。流程图可在下方石煤提钒部分看到。
直接焙烧提钒法
一般包括焙烧、浸出、沉钒、制偏钒酸铵和锻烧几个步骤。焙烧时不加任何添加剂,靠空气中的氧在高温下将低价钒直接转化为酸可溶的V₂O₅。然后用硫酸将焙烧产物中的V₂O₅以五价钒离子形态浸出,再对浸出液净化,除去Fe等杂质,并用水解沉淀法或铵盐沉淀法沉淀红钒,再将红钒碱解于热的烧碱水溶液中,控制适当浓度和酸碱度,使溶液中的钒主要以[VO₃(OH)]²⁻形态存在,澄清后取上清液采用铵盐沉淀法制偏钒酸铵,再锻烧即得高纯V₂O₅。该法已用于含钒石煤的提钒。
钙化焙烧提钒法
将石灰或含钙化合物作溶剂添加到含钒固废中造球、焙烧,使钒氧化成不溶于水的钒钙盐,如 Ca(VO₃)₂、Ca₃(VO₄)₂、Ca₂V₂O₇,再用酸将其浸出,并控制合理的酸碱度,使之生成VO₂⁺或[V₁₀O₂₈]⁶⁻等离子,同时净化浸出液,除去Fe等杂质。然后采用铵盐法沉钒、制偏钒酸铵并锻烧得高纯V₂O₅。钙化焙烧法已应用于石煤提钒中。
溶剂萃取提钒法
用焙烧、酸浸、碱浸等手段将含钒固废中的钒转变为水溶性或酸溶性的含钒离子团,如[HV₁₀O₂₈]⁵⁻、[VO₃(OH)]²⁻、V₂O₇⁴⁻、 [V₄O₁₂]⁴⁻、VO₃⁻、 VO₂⁺(溶液酸碱值不同,离子团也不同),然后用萃取剂(如N-263 、7402)萃取,并发生阴或阳离子交换,如:采用N-263在pH=5时萃取[HV₁₀O₂₈]⁵⁻,发生反应: [HV₁₀O₂₈]⁵⁻+5R₃N+CH₃C1-(O)--(R₃N+CH₃)₅[HV₁₀O₂₈]⁵⁻(O)+5C1-((O)表示有机相),由于其它金属离子大都不能进入有机相中,从而实现了钒与金属杂质离子的分离。经萃取的有机溶液,再用反萃剂(如NH₄CI、氨水)反萃,使钒再从有机相转入水相,然后调整pH值,使钒以多钒酸铵或偏钒酸铵的形态沉淀,再锻烧沉淀物即得高纯V₂O₅。
由于含钒离子、萃取剂及反萃剂的种类都很多,所以相应提钒工艺也多,但工艺路线相近,一般为:制含钒离子_萃取_反萃_沉钒_脱氨得V₂O₅。此法已成功应用于石煤、低钒钢渣、废钒催化剂提钒。
24,铬 キローミュㇺ
自然界没有单质铬。铬的主要矿物是铬矿(Chromite, FeCr₂O₄、MgCr₂O₄)。
FeCr₂O₄ + 4H₂SO₄ ══ FeSO₄ + Cr₂(SO₄)₃ +4H₂O
MgCr₂O₄ + 4H₂SO₄ ══ MgSO₄ + Cr₂(SO₄)₃ +4H₂O
加入臭氧并加入过量氢氧化钠可去除铁、镁:
2Fe²⁺ + O₃ + 4OH⁻ + H₂O ══ 2Fe(OH)₃↓+ O₂
MgSO₄ + 2NaOH ══ Mg(OH)₂↓+ Na₂SO₄
2Cr³⁺ + 3O₃ + 10OH⁻ ══ 2CrO₄²⁻ + 3O₂ + 5H₂O
去除掉沉淀之后加入氯化锶可以实现铬的富集:
Sr²⁺ + CrO₄²⁻ ══ SrCrO₄↓
碱熔法
铬也可以通过在空气中碱熔得到:
4FeCr₂O₄ + 16NaOH + 7O₂ ══△ 2Fe₂O₃ + 8Na₂CrO₄ + 8H₂O↑
加入水之后溶解、过滤沉淀即可得到铬酸钠溶液,经过蒸干可得Na₂CrO₄。
金属铬的冶炼
2Na₂CrO₄ + 3H₂ ══△ 4NaOH + Cr₂O₃ + H₂O↑
Cr₂O₃ + 3H₂ ══△ 2Cr + 3H₂O
25,锰 manganum マㇴガヌㇺ
还原二氧化锰可得金属锰
MnO₂ + C ══△ Mn + CO₂↑
26,铁 フエルㇺ
Fe₂O₃ + 3H₂(过量) ══△ 2Fe + 3H₂O
铁矿石的纯化
加入热浓硫酸酸解并去除未被酸解的沉淀,之后加入水中水解产生氢氧化铁沉淀,这一过程可以去除掉碱金属元素(碱元素)、碱土金属元素(碱土元素)、稀土元素、钴、镍、贵金属等等:
Fe₂O₃ + 3H₂SO₄ ══ Fe₂(SO₄)₃ + 3H₂O
Fe₂(SO₄)₃ + 6H₂O ══ 2Fe(OH)₃↓+ 3H₂SO₄
从新加热得到三氧化二铁
2Fe(OH)₃ ══△ Fe₂O₃ + 3H₂O↑
空气中碱熔去除钛、钒、铬、锰、锆、铌、钼、钨、钌、铑、铪、钽、锇、锡等等
TiO₂ + 2NaOH ══ Na₂TiO₃
4FeCr₂O₄ + 16NaOH + 7O₂ ══△ 2Fe₂O₃ + 8Na₂CrO₄ + 8H₂O↑
4MnO₂ + 4NaOH + 3O₂ ══△ 4NaMnO₄ + 2H₂O↑
Ta₂O₅ + 2NaOH ══△ 2NaTaO₃ + H₂O↑
之后用氢氧化钠溶液冲洗多次,得到纯的三氧化二铁。
三氧化二铁经过氢气还原可得到纯铁:
Fe₂O₃ + 3H₂(过量) ══△ 2Fe + 3H₂O
27,钴 コバㇻト゚ㇺ
制备方法(铜钴矿)
铜钴矿经选矿获得氧化精矿和硫化精矿,也就是[イCoO+ロCuO]、[イCoS+ロCu₂S₂]、[イCoS₂+ロCu₂S₂],其中,硫化铜CuS实际上就是过硫化亚铜Cu₂S₂,由Cu⁺和S₂²⁻构成;黄铁矿FeS₂实际上就是过硫化亚铁,怪不得硫酸铜可以与硫化氢反应,不仅生成了更加稳定的共价化合物,且属于氧化还原反应:
2CuSO₄ + 2H₂S ══ Cu₂S₂↓+ 2H₂SO₄
氧化精矿品位为:铜25%,钴1.5%;硫化精矿品位为:铜45%,钴2.5%。首先将硫化精矿在流态化焙烧炉内进行硫酸化焙烧,然后将焙砂和氧化精矿一起用铜电解废液浸出。氧化精矿中的钴主要呈三价氧化物形态,在硫酸中溶解度很小,但在铜电解废液中可由其中的亚铁离子将钴还原,溶于电解废液中:
Co³⁺(难溶)+Fe²⁺ ══ Co²⁺(可溶)+Fe³⁺
钴的浸出率可达95%~96%。含钴和铜的浸出液用电解法析出铜,而钴和其他金属杂质留在溶液中。除杂质后,将溶液中的钴用石灰乳沉淀为氢氧化钴,再溶于硫酸中,得到高浓度的硫酸钴溶液,最后用不溶阳极电积金属钴。
28,镍 ニㇰコルㇺ
镍化学性质较活泼,但比铁稳定。室温时在空气中难被氧化,可被浓硝酸钝化。细镍丝可燃,加热时与卤素反应,在稀酸中缓慢溶解。能吸收相当数量氢气。
焙烧镍矿石可以得到氧化镍:
2NiS + 3O₂ ══△ 2NiO + 2SO₂
通过还原氧化镍可以得到镍
NiO + CO ══△ Ni + CO₂
但是这种方法得到的镍含有铁杂质。
纯净镍可通过一氧化碳分离
Ni + 4CO ══ Ni(CO)₄
Fe + 5CO ══ Fe(CO)₅
经过精馏分离可得纯净的Ni(CO)₄
加热分解可得纯净镍
Ni(CO)₄ ══△ Ni + 4CO↑
29,铜 クㇷ゚ルㇺ
铜矿的富集、纯化
CuO + H₂SO₄ ══△ CuSO₄ + H₂O
铜可以与过量碳酸钠形成可溶性配合物:
CuSO₄ + 2Na₂CO₃ ══ Na₂[Cu(CO₃)₂] + Na₂SO₄
铜矿酸解于硫酸形成硫酸铜,之后加入过量氢氧化钠形成氢氧化铜沉淀:
CuSO₄ + 2NaOH ══ Cu(OH)₂ + Na₂SO₄
之后过滤沉淀并冲洗,然后加入过量碳酸钠:
Cu(OH)₂ + 2Na₂CO₃ ══ Na₂[Cu(CO₃)₂] + 2NaOH
过滤掉未反应的沉淀之后,对溶液进行加热:
2Na₂[Cu(CO₃)₂] + 3H₂O ══△ 4NaOH + Cu₂(OH)₂CO₃ + 3CO₂↑
铜的冶炼
Cu₂(OH)₂CO₃ ══△ 2CuO + CO₂↑+ H₂O
CuO + H₂ ══△ Cu + H₂O
铜的精炼
在铜的电解精炼过程中,加入硫酸锌或者硫酸铝可以去除掉溶液中的砷,产生AlAsO₄、AlAsO₃等等沉淀;加入硫酸钠可以去除溶液中的锑,产生Na[Sb(OH)₆]沉淀,用新制的氢氧化铜调节溶液酸碱性可去除溶液中的铋,产生BiO(OH)沉淀。
Cu ══电解精炼 Cu
⁶⁵Cu的分离
4 ¹⁴NH₃ + 5 ¹⁶O₂ ══ 4 ¹⁴N¹⁶O + 6H₂¹⁶O
2 ¹⁴N¹⁶O + ¹⁶O₂ ══ 2 ¹⁴N¹⁶O₂
Cu + 2N₂O₄ ══ Cu(NO₃)₂ + 2NO
Cu(NO₃)₂ 可通过升华分馏得到纯净的⁶⁵Cu。
铜也可以通过置换反应得到,如果设计成原电池的话,效果会更好,纯度会更高:
Mg + CuCl₂ ══ MgCl₂ + Cu
斯反应既可用作环保能源,其使用结束之后亦可用作生产单质铜的技术。
Zn + CuCl₂ ══ ZnCl₂ + Cu
曾青得鐵則化爲銅 | 硫酸铜溶液遇到铁产生铜单质 | 传统湿法冶铜:
Fe + CuSO₄ ══ FeSO₄ + Cu
但是这种方法生产的铜含有大量铁杂质,需要进一步地电解精炼。
酞菁铜类化合物的生产方法
酞菁铜也可以由邻苯二腈与亚铜离子在热的丙醇与水的混合溶液中反应得到:
4C₆H₄(CN)₂ + 2[Cu(NH₃)₂]Cl ══ [CuPc]↓+[Cu(NH₃)₄]Cl₂
也可以生产颜料绿7: 4C₆Cl₄(CN)₂ + 2[Cu(NH₃)₂]Cl ══ [CuPch]↓+[Cu(NH₃)₄]Cl₂
颜料绿36的全溴版本: 4C₆Br₄(CN)₂ + 2[Cu(NH₃)₂]Cl ══ [CuPbr]↓+[Cu(NH₃)₄]Cl₂
此种酞菁颜料的生产方法的版权归上帝保管!
此方法可得到高纯度酞菁颜料,也可以用于服装的酞菁颜料上染,且稳定性极高!
此方法得到的酞菁绿,其氢原子完全被氯原子或者溴原子取代,从而加强卤键作用,使其具有更高的对称性和稳定性。工业上通过氯取代酞菁蓝生产的颜料绿7的平均氯取代数为14~15,存在对称性低、氢电离等等问题,会降低其耐晒性能;而亚铜法生产的颜料绿7的平均取代可达最高值16,且对于溴原子也是如此,可以具有极好的耐晒性能!调整邻苯二腈上的取代原子可以得到更多酞菁蓝、酞菁绿,比如[CuPc](颜料青15:3)、[Cup(H₁₂Cl₄)]、[Cup(H₈Cl₈)]、[Cup(H₄Cl₁₂)]、[CuPch](颜料绿7)、[Cup(Cl₁₂Br₄)]、[Cup(Cl₈Br₈)](颜料绿36)、[Cup(Cl₄Br₁₂)]、[CuPbr](全溴酞菁铜)
颜料青15:1则可由无水氯化铜与邻苯二腈加热得到:
CuCl₂ + 4C₆H₄(CN)₂ ══△ [Cup(H₁₅Cl)] + HCl↑
氯化亚铜的制取:
Cu + CuCl₂ ══ 2CuCl
氯化亚铜氨的制取:
CuCl + 2NH₃ ══ [Cu(NH₃)₂]Cl
Cu + CuCl₂ + 4NH₃ ══ 2[Cu(NH₃)₂]Cl
其中,氨要过量
Cu + [Cu(NH₃)₄]Cl₂ ══ 2[Cu(NH₃)₂]Cl
30,锌 チㇴクㇺ
ZnCO₃ ══△ ZnO + CO₂
2ZnO + C ══△Zn + CO₂
向锌化合物溶液中加入过量氢氧化钠可以去掉其他过渡元素:
ZnCl₂ + 4NaOH ══ Na₂[Zn(OH)₄] + 2NaCl
MnCl₂ + 2NaOH ══ Mn(OH)₂↓+ 2NaCl
在低压中,通过对Zn³⁷Cl₂或者Zn³⁵Cl₂进行分馏可以实现锌的同位素分离。
31,镓 カㇻリュㇺ
制备方法
可由铝土矿或闪锌矿中提取。最后经电解制得纯净镓。
主要从炼锌废渣和炼铝废渣中回收提取。 工业生产以工业级金属镓为原料,用电解法、减压蒸馏法、分步结晶法、区域熔融法进一步提纯,制得高纯镓。电解法以99.99%的工业级金属镓为原料,经电解精炼等工艺,制得高纯镓的纯度≥99.999%。以≥99.999%的高纯镓为原料,经拉制单晶或其他提纯工艺进一步提纯,制得高纯镓的纯度≥99.99999%。
汞齐电解法
汞齐法的优点是工艺、设备均比较简单,投资低,在回收纯度较高的金属镓的同时还可以回收钒。但由于该方法使用有剧毒的毒金属元素汞,所以现在已经被大多数国家禁用。
石灰乳法
1952年,该方法由美国铝业公司(Alcoa,アㇻコア)研究成功,1957年,中国和苏联用于工业生产。该方法的原理是用石灰乳(氢氧化钙的悬浊液)处理氧化铝生产的循环铝酸钠溶液,使镓与铝分离,然后回收富集的镓。这种方法的优点是能从镓浓度低的循环铝酸钠溶液中回收镓,缺点是使循环碱液中的NaOH转化为NaHCO₃及Na₂CO₃,需要使用大量石灰苛化后才能返回氧化铝生产流程。
反应式为
Ca(OH)₂ + 2Na[Ga(OH)₄] ══ Ca[Ga(OH)₄]₂ +2NaOH
Ca(OH)₂ + 2Na[Ga(OH)₄] ══ [Ca(AlO₂)₂+4H₂O]↓+ 2NaOH
士大夫评论
由于钪系收缩,氢氧化镓的酸性要强于氢氧化铝,可以利用二者在酸性上的差异实现镓与铝的分离:
Ga(OH)₃ + Na₂CO₃ + H₂O ══ Na[Ga(OH)₄] + NaHCO₃
也就是在酸性上,Ga(OH)₃>Zn(OH)₂>Al(OH)₃>Be(OH)₂
该生产过程中,氢氧化镓被碳酸钠碱解生成可溶性物质,氢氧化铝则不反应。
碱解__二氧化碳法
由于钪系收缩导致的次级周期律, Ga(OH)₃酸性更强, 更容易形成稳定的盐, 更难被二氧化碳酸化:
碱熔
Al₂O₃ + 2NaOH ══ 2NaAlO₂ + H₂O↑
Ga₂O₃ + 2NaOH ══ 2NaGaO₂ + H₂O↑
水合
NaAlO₂ + 2H₂O ══ Na[Al(OH)₄]
NaGaO₂ + 2H₂O ══ Na[Ga(OH)₄]
二氧化碳酸化
Na[Al(OH)₄] + CO₂ ══ Al(OH)₃↓ + NaHCO₃
其中, 由于[Ga(OH)₄]⁻碱性更弱, 更难与二氧化碳反应, 因此实现镓与铝的分离.
溶剂萃取法
该法所用的萃取剂昂贵且萃取剂长期与强碱性铝酸钠溶液接触,溶解损失较大,溶解于种分母液中的萃取剂对后序工艺中的电解也有不利影响。
离子交换法
该方法从拜耳母液中回收金属镓,无需往铝酸钠溶液中加任何试剂,不会影响氧化铝生产工艺,且其工艺流程短,周期作业,易于实现自动化操作,成本较低,是目前从氧化铝生产中回收镓的最经济的方法,并且已经实现了工业化生产。
32,锗 ゲㇾマーニュㇺ
锗可以通过煤灰富集得到,将煤灰酸浸于浓盐酸,其中的二氧化硅无法被酸解,二氧化锗则会发生酸解生成共价化合物四氯化锗:
GeO₂ + 4HCl ══△ GeCl₄↑+ 2H₂O
闪锌矿(ZnS)中含有0.3%的硫化锗,通过焙烧可以使锗被氧化:
GeS₂ + 3O₂ ══ GeO₂ + 2SO₂
在这个过程中,部分锗会进到所产生的灰尘中,而剩下的锗则被转化成锗酸盐,然后被硫酸淋溶,此时在炉渣中的锌也被淋溶。在中和反应后,只有锌留在溶液中,沉淀物中含有锗及其他金属。在用威尔兹冶锌法(Waelz process)把沉淀物中的含锌量减少后,而残馀的威尔兹氧化物则接受第二次淋溶。此时从沉淀物中可得二氧化锗,与氯气或盐酸反应后被转化成四氯化锗,由于它的沸点低,因此可用蒸馏法进行分离:
GeO₂ + 4HCl ══ GeCl₄ + 2H₂O
GeO₂ + 2Cl₂ ══ GeCl₄ + O₂
四氯化锗会被水解成二氧化锗,或用分馏法净化后再被水解。极纯的GeO₂适用于制造锗玻璃。纯二氧化锗与氢反应后被还原成锗,用这种还原方式所得的锗,适用于红外线光学或半导体工业:
GeO₂ + 2H₂ ══△ Ge + 2H₂O
用于钢铁生产及其他工业过程的锗,一般会用碳来还原:
GeO₂ + C ══△ Ge + CO₂
34,硒 セレーニュㇺ
氧化焙烧碱浸提硒
鉴于硒及其化合物在低温下可被氧化为氧化物,该类氧化物易被氢氧化钠浸出。硒被浸出后,转入盐酸介质中,通入二氧化硫还原出硒。一般铜阳极泥在250~380℃下进行氧化焙烧,过程中发生如下化学反应 :
Cu₂Se+2O₂ ══ CuSeO₃+CuO
CuSe+2O₂ ══ CuSeO₄
2Ag₂Se+3O₂ ══ 2Ag₂SeO₃
Ag₂Se+O₂ ══ 2Ag+SeO₂↑
AuSe₂+2O₂ ══ Au+2SeO₂↑
在90℃的温度下,焙烧料用碱浸出,发生如下化学反应:
Ag₂SeO₃+2NaOH ══ Na₂SeO₃+H₂O+Ag₂O (18)
CuSeO₃+2NaOH ══ Na₂SeO₃+H₂O+CuO
SeO₂+2NaOH ══ Na₂SeO₃+H₂O
碱浸出液采用硫酸中和至pH 为7~8时,溶液中的Na₂SeO₃ 转化为H₂SeO₃:
Na₂SeO₃+H₂SO₄ ══ H₂SeO₃+Na₂SO₄
向H₂SeO₃ 的溶液中加入盐酸酸化,并通二氧化硫将H₂SeO₃ 还原为元素硒,得到的粗硒粉含硒99%,其反应方程式为:
H₂SeO₃+2SO₂+H₂O ══ Se↓+2H₂SO₄
Na₂SeO₃+2HCl+2SO₂+H₂O ══ Se↓+2H₂SO₄+2NaCl
加压氧浸提硒
将铜阳极泥加入高压釜中,在温度为160℃~180℃、氧压为250~350 kPa 的情况下进行浸出,碲以Te⁴⁺或Te⁶⁺形态转入溶液,碲与铜浸出率接近100%。浸出渣经过制粒焙烧,阳极泥中的硒被氧化为二氧化硒,经过水吸收,被二氧化硫还原为单质硒。
水溶液氯化提取硒
向浆化的阳极泥中通入氯气,氯气通入矿浆中,与其中的水反应形成强氧化性的HClO,然后,从物料中浸出硒:
H₂O+Cl₂ ══ HCl+HClO
2HClO ══ 2HCl+O₂
Se+2HClO+H₂O ══ H₂SeO3+2HCl
Cu₂Se+4HClO ══ H₂SeO₃+H₂O+2CuCl₂
Ag₂Se+3HClO ══ H₂SeO3+HCl+2AgCl↓
当HClO 过量时,硒及其化合物被氧化形成H₂SeO₄:
Se+3HClO+H₂O ══ H₂SeO₄+3HCl
Cu₂Se+5HClO ══ H₂SeO₄+H₂O+2CuCl₂+HCl
Ag₂Se+4HClO ══ H₂SeO₄+2HCl+2AgCl ↓
3Se+SeO₂+4HCl ══ 2Se₂Cl₂+2H₂O
水溶液氯化的最佳条件是:氯化温度25~80℃、液固比为8、HCl 水溶液中含50~100g·L⁻¹ 氯化钠、氯气用量为1kg 阳极泥0.9~1.3 kg Cl₂。
碳酸钠法提取硒
碳酸钠法是另一种从阳极泥中回收硒的方法,其优点在于:在第一道工序就能使贵金属与硒、碲良好分离,且贵金属回收率高;硒的回收工艺简单;可以综合回收碲与铜。碳酸钠法提硒可分为碳酸钠熔炼法与碳酸钠烧结法。
碳酸钠熔炼法回收硒
将脱铜阳极泥配以料重40%~50% 的苏打,混合均匀并投入电炉中,在450~650℃下进行苏打熔炼,硒与碲转变为易溶于水的硒酸盐或亚硒酸盐,相关化学反应方程式:
2Se+2Na₂CO₃+3O₂ ══ 2Na₂SeO₄+2CO₂
Cu₂Se+Na₂CO₃+2O₂ ══ Na₂SeO₃+CO₂+2CuO
将脱铜阳极泥配以料重40%~50% 的苏打,混合均匀并投入电炉中,在450~650℃下进行苏打熔炼,硒与碲转变为易溶于水的硒酸盐或亚硒酸盐,相关化学反应方程式:
2Cu₂Se+2Na₂CO₃+5O₂ ══ 2Na₂SeO₄+2CO₂+4CuO
CuSe+ Na₂CO₃+2O₂ ══ Na₂SeO₄+ CO₂+CuO
2CuSe+2Na₂CO₃+3O₂ ══ 2Na₂SeO₃+2CO₂+2CuO
SeO₂+Na₂CO₃ ══ Na₂SeO₃+ CO₂
Ag₂Se+Na₂CO₃+O₂ ══ Na₂SeO₃+CO₂+2Ag
2Ag₂Se+2Na₂CO₃+3O₂ ══ 2Na₂SeO₄+2 CO₂+4Ag
2Na₂SeO₃+O₂ ══ 2Na₂SeO₄
苏打熔炼反应起始于300℃,在500~600℃时,反应便剧烈进行;温度达到700℃,则会有SeO₂ 的明显挥发。为了保证氧化反应完全进行,使硒生成水溶性盐,苏打熔炼温度应控制在650~700℃进行。
苏打熔炼法回收硒的典型工艺流程见下图:
苏打熔炼法回收硒的典型工艺流程
苏打烧结法回收硒
此法适于处理贫碲高硒的阳极泥物料,因高碲料会妨碍获得纯硒。将含Se21%、Te1%的阳极泥配入料重9%的苏打,加水调成稠浆,挤压制粒、烘干,投入电炉内,保持低于烧结温度下,控制在450~650℃通入空气进行苏打烧结,硒转化为硒酸钠或亚硒酸钠。烧结料用80~90℃热水浸出,在通空气搅拌的情况下,得到含铜62g·L⁻¹、银3.6g·L⁻¹ 的亚硒酸盐溶液,此浸出液经浓缩至干,干渣配上炭在600~625℃的电炉内还原熔炼而得到Na₂Se:
Na₂SeO₃+3C ══ Na₂Se+3CO
Na₂SeO₄+4C ══ Na₂Se+4CO
水溶解Na₂Se,过滤得到的残渣返回利用。向滤液鼓入空气氧化而得到灰硒产物:
2Na₂Se+2H₂O+O₂ ══ 2Se↓+4NaOH
在此过程中,90% 的硒自溶液中析出,经水洗即得粗硒,硒的总回收率在93%~95% 的范围内。
真空蒸馏提硒法
利用硒的低沸点,而铜、铅、锌、金、银等沸点较高的的特性,将硒与杂质分离。将含硒物料投入真空蒸馏炉内,加温到300~500℃,含硒物料熔融,控制真空度为13~30 Pa,蒸馏与保温2~3 h,物料中的硒被蒸馏出来,导入冷凝室冷凝于270~300℃,从冷凝物回收得到92% 的粗硒,经处理除杂得99.5% 硒;而高沸点难挥发的其他物质残留在蒸馏渣中,可从蒸馏渣中分别综合回收有价金属。
35,溴 ㇷ゙ローミュㇺ
盐卤池中加入氯气可得溴
2Br⁻ + Cl₂ ══ Br₂ + 2Cl⁻
之后鼓入热风可以分离溴元素。
由于氯、溴可以氧化碘离子生成碘酸根离子,所以自身就可以实现溴与碘的分离:
I⁻ + 3Cl₂ + 3H₂O ══ IO₃⁻ + 6H⁺ + 6Cl⁻
I⁻ + 3Br₂ + 3H₂O ══ IO₃⁻ + 6H⁺ + 6Br⁻
溴的核素分离
溴与去氘氢反应:
Br₂ + H₂(プロテュム)══△ 2HBr(プロテュム)
对HBr(プロテュム)进入精馏可以分离⁷⁹Br和⁸¹Br。
36 | 54,氪 | 54,氙
通过液态空气分馏可得氪、氙。对高纯度氪、氙进入分馏可得到多种核素。
37,铷 ルビ台ュㇺ
虽然铷在地壳中比铯更常见,但其应用远远不如铯化合物广泛,这是因为铷与钾共生导致缺乏富含铷的矿物,所以各种铷化合物的年产量只有2~4吨。分离钾、铷和铯的方法有若干种。对硫酸铷(Rb₂SO₄)和硫酸铯(Cs₂SO₄)重复进行分级结晶,30次以后便可获得纯铷矾(果然像镝一样难以取得!不过镝已经有了更好的获取方法!)。另外二种方法分别利用氯锡酸盐和亚铁氰化物。
アㇻカㇻㇷ゙法
1950至1960年代,钾生产过程中一种称为“Alkarb(アㇻカㇻㇷ゙)”的副产品曾经是铷元素的主要来源。Alkarb含21%的铷,其余大部分是钾,另有少量铯。如今,铷是铯开采过程中的一种副产品,加拿大曼尼托巴省(マニトバ)的铯榴石矿就是其中一例。
38,锶、钡、镭的分离
SrSO₄ + 2C ══△ SrS + 2CO₂
在硫化锶的丙醇溶液中加入过量氢氧化钠的丙醇溶液可以得到氢氧化锶固体:
SrS + 2NaOH ══ Sr(OH)₂↓+ Na₂S
将氢氧化锶过滤并溶于热水,使用臭氧可以去除掉氢氧化锶沉淀中的硫元素:
Na₂S + 4O₃ + Sr(OH)₂ ══ SrSO₄↓+ 2NaOH + 4O₂
通过降温重结晶可以纯化锶。
锶也可以通过碳酸钠法生产:
SrSO₄ + Na₂CO₃ ══ SrCO₃ + Na₂SO₄
也就是生成了溶解度更小的沉淀。
在碳酸铵(NH₄)₂CO₃的浓溶液中可以去除掉碳酸锶等等锶化合物中的钡元素,推测是由于碳酸铵可以与Ba²⁺形成可溶性配合物,应该是(NH₄)₄[Ba(CO₃)₃]或者[Ba(NH₃)₈](HCO₃)₂或者(NH₄)₂[Ba(CO₃)₂],有三种可能性:
可能性イ
BaCO₃ + 2(NH₄)₂CO₃ ══ (NH₄)₄[Ba(CO₃)₃]
可能性ロ
BaCO₃ + 7(NH₄)₂CO₃ ══ [Ba(NH₃)₈](HCO₃)₂ + 6NH₄HCO₃
可能性ハ
BaCO₃ + (NH₄)₂CO₃ ══ (NH₄)₂[Ba(CO₃)₂]
碳酸铵可由二氧化碳与氨同时通入水中得到,或者由碳酸氢铵与氨反应得到,其溶解度大于碳酸氢铵:
2NH₃ + CO₂ + H₂O ══ (NH₄)₂CO₃
NH₄HCO₃ + NH₃ ══ (NH₄)₂CO₃
碳酸镭更容易形成配位化合物,且其配合物的在碳酸铵溶液中的溶解度是碳酸钡的11倍,可以以此从锶、钡中分离出镭:
RaCO₃ + 7(NH₄)₂CO₃ ══ [Ra(NH₃)₈](HCO₃)₂ + 6NH₄HCO₃
在室温时,碳酸镭在碳酸铵或氯化铵浓溶液中的溶解度比碳酸钡大10倍,借此可将镭与钡分离。它可用于制造镭铍中子源。
铯餐
虽然硫酸钡可用于钡餐、矾土水泥,但是由于钡餐存在禁忌症,也就是消化道功能不全者、消化道穿孔者、消化道出血者不适用于钡餐,因此可以使用其他难溶性重元素盐类代替硫酸钡,比如CsLa(SO₄)₂、KCe(SO₄)₂。其中,CsLa(SO₄)₂价格贵,但是没有毒金属钡元素,且呈现抗磁性,所以其不表现任何毒性,可适用于消化道功能不全者、后续需核磁共振的X射线造影透视;KCe(SO₄)₂溶解度大于CsLa(SO₄)₂,且变价元素铈有一些小毒,但其价格低廉,所以其用于普通人的X射线造影透视,且不能与CsLa(SO₄)₂相混淆!
对于消化道穿孔者、消化道出血者,氯化铯则是更好的选择。
士大夫评论:
是不是在未来,钡餐也会被称为【铈餐】、【镧餐】、【铯餐】?!
咔唑
二氧化铈可用作有机化学中的强氧化剂、成环剂,可以代替有毒的二氧化铅、四氧化三铅,比如咔唑的合成过程:
苯肼与环己酮缩合
C₆H₅NHNH₂ + OCC₅H₁₀ ══ C₆H₅NHNCC₅H₁₀ + H₂O
缩合产物形成四氢咔唑
C₆H₅NHNCC₅H₁₀ + HCl ══(浓盐酸催化) C₁₂H₁₃N + NH₄Cl
四氢咔唑被环保型强氧化剂氧化成咔唑:
C₁₂H₁₃N + 4CeO₂ + 12HCl ══ C₁₂H₉N + 4CeCl₃ + 8H₂O
咔唑也可以Graebe–Ullmann反应(ㇰ゙ラエベウㇽマㇴ反应)得到:
锶可用于去除锌中的毒金属铅、镉,推测是因为镉、铅易得电子,可以形成类似于CsAu、AlAg₃的高熔点金属互化物:
2Sr + 9Pb ══ Sr₂Pb₉
Sr + Cd ══ SrCd
3Sr + 2As ══ Sr₃As₂
40 | 72,锆 | 铪
锆 チㇼコーニュㇺ 铪 ハㇷニュㇺ 合称为zircōnihafnium,チㇼコーニハㇷニュㇺ,符号Zh
锆石碱熔:
ZrSiO₄ + 4NaOH ══△ Na₂ZrO₃ + Na₂SiO₃ +2H₂O↑
加入水中,锆酸钠水解,硅酸钠则水溶:
Na₂ZrO₃ + 2H₂O ══ H₂ZrO₃ + 2NaOH
过滤掉锆酸沉淀并多次冲洗,之后加入过量氯化氢:
H₂ZrO₃ + 2HCl ══ ZrOCl₂ + 2H₂O
过滤掉沉淀之后,加入过量的氨可得到氢氧化锆:
ZrOCl₂ + 2NH₃ + 2H₂O ══ H₂ZrO₃↓+ 2NH₄Cl
锆属于两性氧化物,既显酸性,又显碱性,加热二氧化锆的水合物可以得到耐酸碱的无水二氧化锆:
Zr(OH)₄ ══△ ZrO₂ + 2H₂O↑
H₂ZrO₃ ══△ ZrO₂ + H₂O↑
[ZrO₂+イH₂O] ══△ ZrO₂ + イH₂O↑
二氧化锆
由灼烧二氧化锆水合物或挥发性含氧酸锆盐所得的二氧化锆为白色粉末,不溶于水;经由轻度灼烧所得的二氧化锆,比较容易被无机酸酸解;强热灼烧所得的二氧化锆只酸解于浓硫酸和氢氟酸;经过熔融重结晶的二氧化锆只与氢氟酸作用。二氧化铪也是如此。
二氧化锆在加热时发出强烈的白光,可代替二氧化钍用作灯丝和汽油灯的网罩。熔融后的二氧化锆很硬,热膨胀系数很小,用它制作的搪瓷不会因温度骤变而破裂。二氧化锆还可做高温坩埚、耐火器皿和炉衬。掺有氧化镁的二氧化锆可用于制造高温玻璃。
二氧化锆的用途
二氧化锆也可以用作环保白色颜料。
锆铪分离
ZhO₂ + 2Cl₂ + 2C ══△ ZhCl₄ + 2CO
通过对ZhCl₄进行精馏、管道扩散,可以分离四氯化锆与四氯化铪。使用如果氯气使用³⁵Cl₂或者使用³⁷Cl₂,效果会更好,还可以进一步实现锆的同位素分离、铪的同位素分离,可以得到高纯度的⁹⁰Zr、¹⁸⁰Hf(难以吸收中子),分离出来的¹⁷⁷Hf、¹⁷⁸Hf可用作中子吸收剂。极难吸收中子的⁹⁰Zr则可用于核反应燃料棒。
通过ZrI₄的热分解可得高纯度的金属锆
二氧化铪
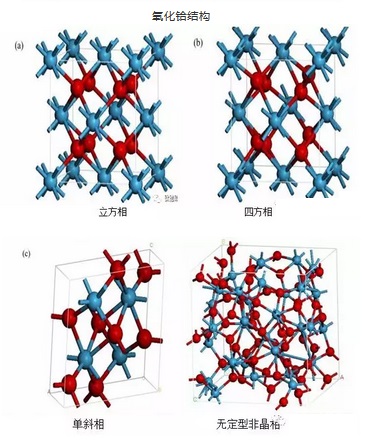
物理性质
二氧化铪(HfO₂)是白色晶体粉末。纯二氧化铪以三种形式存在,一种是无定型状态,另外二种为晶体。在小于400℃煅烧氢氧化铪、氧氯化铪等不稳定的化合物时,可以得到无定型二氧化铪。将其氧化铪继续加热至450~480℃,开始转化为单斜晶体,继续加热至1000~1650℃发生晶格常数逐步增加的趋势,并转化为4个氧化铪分子的单体。当1700~1865℃时开始转化为四方晶系。
向二氧化铪中添加少量氧化镁、氧化钙、氧化锰等氧化铪,在1500℃以上可以形成面心立方晶格的固溶体。如向二氧化铪中加8%~20%氧化钙,则晶格常数α相应从0.5082nm增加至0.5098nm。若添加的量达到形成CaHfO₃时,则晶体结构转化为菱形晶系。 单斜晶体氧化铪的密度为9.68g·cm⁻³,熔点3031K,沸点5673K。
化学性质
二氧化铪的化学性质与可以被视为二氧化锆,其活性与煅烧温度有关,煅烧温度越高,化学活性性越低。无定型二氧化铪容易酸解于酸中,但是结晶型氧化铪即使是在热盐酸或者是硝酸中也不发生反应,而仅蚀解于热浓的氢氟酸或硫酸中。
铪盐水解可以得到两性的氢氧化铪,氢氧化铪在100℃下干燥能够达到HfO(OH)₂,再升高温度即转换为二氧化铪。
在碳化过程中可有Hf₂O₃与HfO形成,但是对此研究较少。
简介
二氧化铪为白色或灰色粉末。不溶于水、盐酸和硝酸和其他一般无机酸,在氢氟酸中缓慢蚀解生成氟铪酸盐。与热浓硫酸或硫酸氢盐作用生成硫酸铪。与碳在氯气存在下混合加热得到四氯化铪。与氟硅酸钾作用生成氟铪酸钾。
性质
二氧化铪为白色立方晶体,比重9.68。熔点2758℃。沸点约5400℃。单斜晶系的二氧化铪在1475~1600℃足量氧气氛中转化为四方晶系。不溶于水和一般无机酸,但在氢氟酸中缓慢蚀解。
化学反应
与热的浓硫酸或酸式硫酸盐作用形成硫酸铪[Hf(SO₄)₂],与碳混合后加热通氯生成四氯化铪(HfCl₄),与氟硅酸钾作用生成氟铪酸钾(K₂HfF₆),与碳在1500℃以上作用形成碳化铪HfC。
41 | 73,铌 | 钽 钽钶矿
名称
铌 ニオビュㇺ
钽 タㇴタルㇺ
钶(columbium,コルㇺビュㇺ)是铌的旧称。
分离方法
钽矿石一般含有大量铌元素,因此二者皆会被提炼后出售。整个湿法冶金过程由淋洗开始,矿石酸解在氢氟酸和硫酸中,产生水溶氢氟化物。这样就可以把钽从各种非金属杂质中分离出来。
Ta₂O₅ + 14HF ══ 2H₂[TaF₇] + 5H₂O
Nb₂O₅ + 10HF ══ 2H₂[NbOF₅] + 3H₂O
氢氟化钽和氢氟化铌可经溶剂提取法从水溶液中提取出来,适用的有机溶剂包括环己酮和甲基异丁基酮。这一步会移除各种金属杂质(如铁、锰、钛、锆)的水溶氟化物。通过调节pH值可将钽从铌中分离出来。铌在有机溶剂中需较高的酸度才可溶解,因此在酸度较低的环境下可以轻易地移除并生成水合氧化铌沉淀[Nb₂O₅+7H₂O]↓。剩余的纯氢氟化钽溶液在经氨水中和之后,会形成氢氧化钽(Ta(OH)₅),煅烧后产生五氧化二钽(Ta₂O₅):
2H₂[NbOF₅] + 10NaOH ══ [Nb₂O₅+7H₂O]↓+ 10NaF
H₂[TaF₇] + 5H₂O + 7NH₃ ══ Ta(OH)₅↓+ 7NH₄F
2Ta(OH)₅ ══△ Ta₂O₅ + 5H₂O
氢氟化钽还可以与氟化钾反应形成七氟钽酸钾(K₂[TaF₇])
H₂[TaF₇] + 2KF ══ K₂[TaF₇] + 2HF
它与钠在800 °C左右的熔融盐中会发生还原反应,从而制成钽金属。
K₂[TaF₇] + 5Na ══ Ta + 5NaF + 2KF
更早期的一种分离方法在氢氟化物混合溶液中加入氟化钾,这种过程叫做德马里尼亚过程(De Marigna过程,伝マリ然过程)。
H₂[TaF₇] + 2KF ══ K₂[TaF₇] + 2HF
H₂[NbOF₅] + 2KF ══ K₂[NbOF₅] + 2HF
这样产生的K₂[TaF₇]和K₂[NbOF₅]具有不同的水溶性,所以能利用分离结晶法分开。
五氧化二钽用途
五氧化二钽可用于生产环保黄色颜料:
Ta₂O₅ + 2NH₃ ══△ 2TaON + 3H₂O
合成柠檬钽黄:
TaON + CaCO₃ ══△ CaTaNO₂ + CO₂
柠檬钽黄就像有机颜料一样,其价带大于标准电势,所以其不会像二氧化钛那样引起水分解并产生恐怖的活性氧。少数有机颜料反而存在光敏脆化现象,也就是某些黄、橙、红色还原染料,比如还原黄2、还原黄4,甚至有人认为还原黄1也存在这个问题,但是这样的有机颜料耐光性很差。
合成钽橙: La₂O₃ + MgO +TaON ══△ La₂MgTaNO₅
但不知道钽橙的价带是不是大于标准电势。
五氧化二铌用途
五氧化二铌可用于电解法生产金属铌:
2Nb₂O₅ ══(通电) 4Nb + 5O₂↑
氢还原生产金属铌:
Nb₂O₅ + 5H₂ ══△ 2Nb + 5H₂O
一氧化铌可由归中反应得到:
Nb₂O₅ + 3Nb ══ 5NbO
混合冶金法
Nb₂O₅ + 5H₂ ══△ 2Nb + 5H₂O
Fe₂O₃ + 3H₂ ══△ 2Fe + 3H₂O
更多内容请见混合冶金法
五氧化二铌可用于吸收紫外线的白色颜料,且不会像二氧化钛那样引起糖尿病。这是因为五氧化二铌的价带的能级为0.09eV(电子伏特),大于标准电势0eV,所以五氧化二铌不会引起水分解,二氧化钛则会引起水分解并产生恐怖的活性氧。五氧化二铌之所以能吸收紫外线,是因为五氧化二铌的能带间隙为3.4电子伏特,相当于可以吸收波长最长为352纳米的紫外线;而可见光与紫外线的界限为364纳米,也就是巴耳末系中能量最高的光。
$\frac{1200}{3.4}=352$ (截尾法)
美醫學研究:牙膏內二氧化鈦可能導致糖尿病
醫學研究人員認為牙膏、防曬乳、化妝品等多種接觸人體的日常用品中常見的二氧化鈦,可能與部份人罹患第二型糖尿病有關。
美國德克薩斯大學的研究人員發現,在牙膏、食品、化妝品、衛生用品與藥劑中的常見添加物二氧化鈦,可能會導致使用者罹患第二型糖尿病機率升高。這份研究報告已經發佈在《毒物化學研究》(Chemical Research in Toxicology)期刊上。
據英國《每日郵報》報導,二氧化鈦在目前多種日常用品中被廣泛使用,在需要呈現白色的產品中尤為常見。上世紀中葉時,工業界開始用它來取代鉛基的塗料與染料,以避免使用有害人體健康的含鉛物質。到1960年代,它的物理與化學性質經過廣泛研究,認為二氧化鈦對人體無害,因而更加大量地使用於接觸人體的日常用品上,此後每年大約消耗400萬噸於牙膏、防曬乳液、洗潔劑、化妝品、紙張、油漆等各類產品中。
42,钼 モリ与ㇷ゙太エヌㇺ
氧化焙烧
将辉钼矿进行焙烧得到钼焙砂,然后通过升华法或湿法制得三氧化钼,用氨浸出时生成钼酸铵进入溶液,与不溶物加以分离:
2MoS₂ + 7O₂ ══ 2MoO₃ + 4SO₂
MoO₃ + 2NH₃ + H₂O ══ (NH₄)₂MoO₄
溶液经浓缩结晶得到钼酸铵晶体,或加酸酸化生成钼酸沉淀,从而与可溶性杂质分离。二者经煅烧后都生成纯净的三氧化钼,然后用氢还原法生产金属钼:
(NH₄)₂MoO₄ ══△ MoO₃ + 2NH₃↑+ H₂O↑
根据焙烧设备或添加组分的不同,可将该方法分为回转窑焙烧工艺、反射炉焙烧工艺、多膛炉焙烧工艺、流化床焙烧工艺、闪速炉焙烧工艺。该方法会产生大量的烟气,污染环境,钼回收率较低,伴生的稀有元素铼(レーニュㇺ)几乎全部随着烟气跑掉,也就是生成了七氧化二铼蒸气Re₂O₇,不适于处理低品位矿石和复杂矿。
4ReS₂ + 15O₂ ══ 2Re₂O₇ + 8SO₂
硝酸浸出法
在高压釜内使MoS₂氧化为可溶性钼酸盐,该方法主要是消耗廉价的氧化剂-空气或纯氧。该方法需要高温高压,对反应设备要求高,反应条件可靠,生产技术难度大,浸出过程的工艺条件也较难控制,生产过程中也存在一定的安全隐患,目前国内已暂停使用该方法。
次氯酸钠浸出法
主要用于处理低品味中矿、尾矿的浸出。在氧化浸出过程中,次氯酸钠本身也会缓慢分解析出氧,其他一些金属硫化物也会被次氯酸钠氧化,这些金属的离子货氢氧化物又会与钼酸根生产钼酸盐沉淀,促进溶液的钼又返回到渣中。该方法反应条件温和,生产易于控制,对设备要求不高,但原料次氯酸钠消耗量大而造成生产成本过高。
MoS₂ + 9NaClO +6NaOH ══ Na₂MoO₄ +2Na₂SO₄ + 9NaCl + 3H₂O
电氧化浸出法
是由次氯酸钠法改进而来,该方法是将已经浆化的辉钼矿物料加入到装有氯化钠溶液的电解槽中,在电氧化过程中,阳极产物Cl₂与水反应,生产次氯酸根,次氯酸根再氧化矿物中的硫化钼,使钼以钼酸根形态进入溶液中,同时得到氢气:
MoS₂ + 12H₂O ══(NaCl溶液中通电) H₂MoO₄ + 2H₂SO₄ + 9H₂↑
该方法继承了次氯酸钠浸出率高、反应条件温和、无污染的特点,并且能够较为方便的控制、调节反应的方向、限度、速率。
目前也出现了一些新方法,如辉钼矿精矿不经氧化焙烧,直接用氧压煮法或细菌浸出法提取纯三氧化钼。对低品位氧化矿用硫酸浸出,从溶液中用离子交换法或萃取法提取纯三氧化钼。
75,钼的伴生物铼 レーニュㇺ
铼可以通过钼矿副产物获取:
4ReS₂ + 15O₂ ══ 2Re₂O₇ + 8SO₂
用氢氧化钠吸收焙烧辉钼矿产生的气体可以得到铼元素:
Re₂O₇ + 2NaOH ══ 2NaReO₄ + H₂O
2ReS₂ + 19NaClO +10NaOH ══ 2NaReO₄ +4Na₂SO₄ + 19NaCl + 5H₂O
2ReS₂ + 24H₂O ══(NaCl溶液中通电) 2HReO₄ + 4H₂SO₄ + 19H₂↑
钼酸钠、钼酸铵、高铼酸钠经过酸化、升华、提纯之后,经过氢气还原可以得到纯净的钼、铼:
Re₂O₇ + 7H₂ ══△ 2Re + 7H₂O
MoO₃ + 3H₂ ══△ Mo + 3H₂O
50,锡 주석 ㇲタㇴヌㇺ ツー杉ㇰ | ツ杉ㇰ
二氧化锡被还原可以得到具有流动性的锡单质:
SnO₂ + C ══△ Sn + CO₂↑
锡的提纯
锡酸解于过量盐酸得氯化亚锡,之后去除掉氯化亚锡溶液中的渣滓,氯化亚锡溶液经过氧化之后加热可得到二氧化锡沉淀,从而提纯锡:
Sn(白锡,백석,ペㇰ杉ㇰ) + 2HCl ══ SnCl₂ + H₂↑
2SnCl₂ + O₂ + 4HCl ══ 2SnCl₄ + 2H₂O
四价锡很容易发生水解反应,可以以此实现锡与其他元素的分离:
SnCl₄ + 4H₂O ══△ Sn(OH)₄↓+4HCl
过滤、多次冲洗氢氧化锡,之后加热可以得到纯化的二氧化锡:
Sn(OH)₄ ══△ SnO₂ + 2H₂O↑
注意,灰锡(회석,ホイ杉ㇰ)与盐酸直接得到氯化锡(SnCl₄)。为了避免锡疫,可以在锡中掺杂铜、锌得到强化锡。
锡与氯三十五核素组成的氯气反应得到四氯化锡,经过分馏、管道扩散可实现锡的同位素的分离:
Sn + 2 ³⁵Cl₂ ══点燃 Sn ³⁵Cl₄
最终可分离得到 ¹¹²Sn³⁵Cl₄(双β⁺)、¹¹⁴Sn³⁵Cl₄、¹¹⁵Sn³⁵Cl₄、¹¹⁶Sn³⁵Cl₄、¹¹⁷Sn³⁵Cl₄、¹¹⁸Sn³⁵Cl₄、¹¹⁹Sn³⁵Cl₄、¹²⁰Sn³⁵Cl₄、¹²²Sn³⁵Cl₄(双β⁻)、¹²⁴Sn³⁵Cl₄(双β⁻)。
53,碘 ヨ豆ㇺ jodum
碘的矿物较罕见,且大部分浓度够高、足够提供经济上萃取价值的矿床几乎都是碘酸盐。例如碘钙石(Ca(IO₃)₂)、碘铬钙石([7Ca(IO₃)₂+8CaCrO₄] ),在智利的钙质层中(主要用于制造硝酸钠),这些矿物常以微量杂质存在,它们总共含0.02%~1%的质量分数。碘酸钠可由钙质层中萃取,再用亚硫酸氢钠还原为碘盐,这个溶液接着与刚萃取出的碘酸盐混合产生归中反应,得到可被过滤出的碘。
通过养殖海带实现碘的富集,之后将海带干燥,浸取,加入氯化铁并加热,可以得到碘元素:
2KI + 2FeCl₃ ══△ 2KCl + 2FeCl₂ + I₂↑(不加热则是可逆反应)
碘酸钙矿物经过还原可以得到碘:
Ca(IO₃)₂ + 6Na₂SO₃ ══ CaI₂ + 6Na₂SO₄
使用过量硫酸铜可以获取沉淀碘离子:
2CaI₂ + 2CuSO₄ ══ 2CuI↓+ I₂ + 2CaSO₄
之后过滤沉淀,加热溶液,可以得到碘蒸气。沉淀经过冲洗之后可以通过氨水蚀解得到碘:
CuI + 2NH₃ ══ [Cu(NH₃)₂]I
使用氯化铁可以更容易地得到碘,因为氯化铁的氧化性强于碘:
CaI₂ + 2FeCl₃ ══△ CaCl₂ + 2FeCl₂ + I₂↑(不加热则是可逆反应)
55,铯 カエシュㇺ
开采铯榴石是一种选别工艺,和其他大多数金属采矿相比仅以小规模进行生产。首先将矿石击碎,并且进行手工筛选,但是经常不做富集,然后将矿石粉碎。随后主要通过三种方式将铯从铯榴石中提取出来:酸消解、碱消解、以及直接还原。
在酸消解中,硅酸盐铯榴石的岩石酸解在诸如盐酸(HCl)、硫酸(H₂SO₄)、氢溴酸(HBr)或者氢氟酸(HF)中。采用盐酸可以产生可溶解氯化物的混合物。
铯的分离方法
氯化铜法
氯化铜法比锑法、钡法更加环保,比铈法更容易操作
向铯榴石的盐酸浸出液中加入过量氯化铜:
2CsCl + CuCl₂ ══ Cs₂[CuCl₄]↓
过滤沉淀,多次冲洗沉淀,之后向沉淀中加入过量氢氧化钠:
Cs₂[CuCl₄] + 2NaOH ══ 2CsCl + 2NaCl + Cu(OH)₂
三氯化碘法
将三氯化碘(实为六氯化二碘)加入浓盐酸中,并通入氯气加以纯化:
2ICl +2Cl₂ ══ I₂Cl₆
I₂Cl₆ + 2HCl ══ 2HICl₄
2ICl +2Cl₂ + 2HCl ══ 2HICl₄
铯可以形成Cs[ICl₄]沉淀
CsCl + HICl₄ ══ Cs[ICl₄]↓+ HCl
总反应
2CsCl + I₂Cl₆ ══ 2Cs[ICl₄]↓
其中,三氯化碘是溶解在浓盐酸中的。
过滤沉淀,多次冲洗,加热:
2Cs[ICl₄] ══△ 2CsCl + I₂Cl₆↑
氢氧化铯的制取方法
工业上可通过隔膜法电解饱和精制氯化铯溶液可得到氢氧化铯,也就是氯碱法:
2CsCl +2H₂O ══(通电, 隔膜) 2CsOH + H₂↑+ Cl₂↑
碳酸铯可由氢氧化铯吸收空气中的碳酸气得到:
2CsOH + CO₂ ══ Cs₂CO₃ + H₂O
吸收过量二氧化碳可以得到碳酸氢铯:
Cs₂CO₃ + H₂O + CO₂ ══ 2CsHCO₃
同为碱金属元素(碱元素),氢氧化铯、碳酸铯、碳酸氢铯的获得方法之所以异于氢氧化钠、氢氧化钾、碳酸钠、碳酸钾、碳酸氢钠、碳酸氢钾,是因为碳酸氢铯CsHCO₃极易溶于水,20℃时,100克水最多可溶解67.77克碳酸氢铯,所以碳酸氢铯无法通过氨碱法制取,而路布兰法能耗过高,铯既又不像钠一样存在天然碳酸钠,也不像钾一样存在草木灰碳酸钾。所以氢氧化铯、碳酸铯、碳酸氢铯只能通过这种方法得到。
路布兰法 | レㇷ゙ラㇴ法
Cs₂SO₄ + 2C ══△ Cs₂S + 2CO₂↑
Cs₂S + CaCO₃ ══△ Cs₂CO₃ + CaS
总反应:
Cs₂SO₄ + 2C + CaCO₃ ══△ Cs₂CO₃ + CaS + 2CO₂↑
氨碱法是指索尔维法(ソㇿヱー法)、侯氏制碱法的全称,因为其生产过程需要氨。
单质铯的制取方法
将铯榴石与碳酸钙和氯化钙一同烘烤可以得到不易溶解的硅酸盐和可溶解的氯化铯。通过用水沥滤或者用氨水稀释,可以得到稀释的氯化铯溶液。该溶液可以通过蒸发以得到氯化铯或者转变为铯矾(Cs₂SO₄)或者碳酸铯(CsCO₃)。还可以在真空罐中使用钾、钠或者钙对矿石直接还原以直接获得金属铯,但是该方法在经济上不可行。
此外,金属铯可以通过从矿石中得到的提纯化合物获得。氯化铯以及其它卤化铯可以在700℃至800℃的高温下与钙一同加热以将铯还原,然后通过蒸馏得到金属铯:
2CsCl + Ca ══△ 2Cs↑+ CaCl₂
采用相同的方法,碳酸铯以及氢氧化铯等等可以通过使用镁来还原:
Cs₂CO₃ + Mg ══ MgO + 2Cs + CO₂↑
铯还可以通过电解熔融的氰化铯来得到:
2CsCN ══(通电) 2Cs + (CN)₂↑
极纯净并且无气体的铯可以通过以390℃加热叠氮化铯使其分解来得到,而叠氮化铯可以通过碳酸铯溶液和叠氮酸钙反映得到:
Cs₂CO₃ + Ca(N₃)₂ ══ 2CsN₃ + CaCO₃↓
2CsN₃ ══△ 2Cs↑+ 3N₂↑
在真空中,重铬酸铯可以和锆反应得到纯净的铯,而不产生其它气体产物:
Cs₂Cr₂O₇ + 2Zr ══ 2Cs + 2ZrO₂ + Cr₂O₃
2009年纯度为99.8%的金属单质铯大约为每克10美元,但是其化合物便宜很多。
铯的用途补充
大多数以盐的形式开采的铯直接转化为用于诸如油井等应用的甲酸铯(CsHCO₂)。为了向发展中的市场供货,卡博特公司在1997年在位于加拿大马尼托巴的伯尼克湖附近的堂科矿建立了生产厂,年产甲酸铯溶液1900m³。铯的主要小规模商用化合物为氯化铯以及硝酸铯。
钻井液
与传统的硫酸钡悬浊液钻井液(BaSO₄浆料 | BaSO₄钻井液)相比,甲酸铯可以在高温高压条件下保持添加剂的性能,易于被生物降解,不会表现出钡的毒金属性质。2021年10月中海油首次提出在南海超高温高压气田使用甲酸铯钻井液,说明我国的油气公司也将逐渐展开对甲酸铯的应用。一个深井大约需要用甲酸铯500吨,随着国内海上高温高压油气井的开发及环保力度加强,该应用领域将逐步打开快速增长的模式。
目前非放射性铯(稳定铯,¹³³Cs)的最大的用途是石油提取工业中使用的基于甲酸铯的钻井液(CsHCO₂)。通过使氢氧化铯与甲酸反应制成的甲酸铯的水溶液(CsHCO₂(aq))在20世纪90年代中期开始用于油井钻井以及完井液。甲酸铯作为钻井液的功能是润滑钻头,将切下来的岩石带至地表,并且在钻井期间维持对地层的压力。完井液的作用是在钻井完成后生产前辅助控制硬件进驻,而甲酸铯在其中的作用是维持压力。
甲酸铯盐溶液的密度很高,达2.3g·cm⁻³,再加上大多数铯化合物所具有的相对良性的性质,减少了钻井液中有毒的高密度悬浮固体(硫酸钡)的需求。与其它许多高密度液体的成分不同,相对来说甲酸铯不会破坏环境。因此该技术具有很大的技术优势、工程优势以及环境优势。甲酸铯盐溶液可以与甲酸钾、甲酸钠混合以将液体的密度降低至水的密度(1.0g·cm⁻³)。此外,甲酸铯还可以生物降解以及回收,并且可以循环使用,考虑到其较高的价格(每桶4000美元),这一点非常重要。碱元素的甲酸盐可以安全的处理,而且不像他们所替代的高密度盐溶液(如溴化锌溶液)那样具有腐蚀性,因此不会对生产底层或者井下的金属造成损害。使用这些甲酸盐也减少了清洁和处理的费用。
碱元素、碱土元素、稀土元素(yttermidum)、白土元素、毒元素、等等的分类
非放射性物质中
碱元素就是指锂、钠、钾、铷、铯;
碱土元素就是指铍、镁、钙、锶、钡;
稀土元素就是镧系元素、钪、钇、镥;
白土元素是指锆、铪、铌、钽;
催土元素是指钛、钒、铬、锰、铁、钴、镍、铜、锌;
钼土元素是指钼、钨、锝、铼;
贵金属是指钌、铑、钯、银、锇、铱、铂、金;
硼族
铝镓土元素是指硼、铝、镓、铟、铋(相对论效应导致其更加类似于硼族元素)
碳族
硅土元素是指碳、硅、锗、锡、钋
氮族
硝土元素是指氮、磷、砷、锑、砹
氧族元素
磺土元素是指氧、硫、硒、碲
卤族
卤素是指氟、氯、溴、碘
氖族 | ニューㇴ族 | 稀有气体
ニューㇴ族是指ヘーリュㇺ(氦)、ニューㇴ(氖)、アーㇻゴㇴ(氩)、キリ与ㇷ゚トㇴ(氪)、キセノㇴ(氙)、ラ土ㇴ(氡)
毒金属 | 毒元素
传统毒元素是指铅、汞、砷、镉、钡、锑、铍、碲、铊,最新研究又发现贵金属的化合物形态、钛的二氧化钛形态、钒、铬、镍、锗、铟、钨也是毒金属。其中,二氧化钛可以导致II型糖尿病,钒的化合物有剧毒,三价铬会损害肺泡,六价铬则会致癌,镍具有强致敏性,钨会干扰钼的生理功能。
美醫學研究:牙膏內二氧化鈦可能導致糖尿病
醫學研究人員認為牙膏、防曬乳、化妝品等多種接觸人體的日常用品中常見的二氧化鈦,可能與部份人罹患第二型糖尿病有關。
美國德克薩斯(テㇰサㇲ)大學的研究人員發現,在牙膏、食品、化妝品、衛生用品與藥劑中的常見添加物二氧化鈦,可能會導致使用者罹患第二型糖尿病機率升高。這份研究報告已經發佈在《毒物化學研究》(Chemical Research in Toxicology)期刊上。
據英國《每日郵報》報導,二氧化鈦在目前多種日常用品中被廣泛使用,在需要呈現白色的產品中尤為常見。上世紀中葉時,工業界開始用它來取代鉛基的塗料與染料,以避免使用有害人體健康的含鉛物質。到1960年代,它的物理與化學性質經過廣泛研究,認為二氧化鈦對人體無害,因而更加大量地使用於接觸人體的日常用品上,此後每年大約消耗4百萬噸在包括牙膏、防曬乳液、洗潔劑、化妝品、紙張、油漆等各類產品中。
贵金属的分离
贵金属是指锝(technētium,テᆽネーテュㇺ☢️☢️)、钌(ruthenium,ル𠂉ニュㇺ)、铑(rhodium,ロ台ュㇺ)、钯(palladium,パㇻラ台ュㇺ)、银(argentum,アㇻゲㇴト゚ㇺ)、铼(rhēnium | nipponium,レーニュㇺ | ニㇳポㇴユㇺ)、锇(osmium,オㇲミュㇺ)、铱(īridium,イーリ台ュㇺ)、铂(platīnum,ㇷ゚ラ丌ーヌㇺ)、金(aurum,アウルㇺ)。其中钌、铑、钯、锇、铱、铂大量用于催化剂,其化合物毒性强烈,进入肺部会产生贵金属沉淀,所以也叫铂系元素(platinide,platīnidum,ㇷ゚ラ丌ーニ豆ㇺ)。
贵金属的块状单质无毒或者低毒,但是贵金属化合物、细颗粒物、纳米颗粒都有强烈的毒性,比如纳米银、银化合物的细胞毒性远远超过其抗菌活性。银会形成蓝紫色素沉着,金会形成紫红色素沉着。
铜适合做很好的抗菌灭藻活性剂,低浓度的矿物质铜对人体无毒,但对细菌、藻类有强烈的歼灭作用。
像其余的贵金属一样,铂是镍和铜的商业开采加工过程的副产品。在铜的电解精炼过程中,银、金、各铂系金属、硒和碲都会下沉至槽的底部,形成阳极泥。铂系金属的萃取过程便是从这一泥状物质开始的。
如果在飘沙沉积物或其他矿物中发现单质铂,则可以在移除杂质的过程中将铂提取。铂的密度高于大部分的杂质,所以较轻的杂质可以用浮力分离的方式轻易地提取。铂具有顺磁性,而镍和铁都具有铁磁性。混合物经过电磁铁后,镍和铁会被分离出来。铂的熔点较高,因此可以利用高温把不少杂质熔融去除。最后,铂不受氢氯酸和硫酸侵蚀,混合物在任一者中经搅拌后,杂质自然会酸解,剩余的就是铂。
原始铂中也含有金以及其他铂系元素。要纯化原始铂,可以用王水处理。钯、金和铂会被王水(HNO₃+3HCl)(aq)氧化配位蚀解,而锇、铱、钌和铑则不会反应。加入二氯化铁溶液(FeCl₂)后,金会发生沉淀,并可以被过滤出来。加入氯化铵溶液(NH₄Cl)之后,氯铂酸铵会发生沉淀,并被过滤出来,经加热后可以转化为铂金属。未被沉淀的六氯铂酸可以经锌元素(Zn)还原。在实验室中,也可用类似方法从少量残留物中萃取出铂。
剩下的锇、铱、钌、铑不可蚀解于王水,可从铂、金等金属分离开来。铑与熔融态的硫酸氢钠(NaHSO₄)反应后会被分离出来。剩余的物质中含有钌、锇和铱,其中铱不可溶于次氯酸钠溶液。将剩余物质加入次氯酸钠的水溶液会产生水溶的钌盐和锇盐,而在被次氯酸钠氧化后,这些盐会变成挥发性的RuO₄和OsO₄:
Ru + 4NaClO ══△ RuO₄ + 4NaCl
Os + 4NaClO ══△ OsO₄ + 4NaCl
过滤掉铱沉淀之后,氯化铵溶液(NH₄Cl)可将RuO₄还原并沉淀为(NH₄)₃RuCl₆↓:
6RuO₄ + 36NH₄Cl ══ 6(NH₄)₃RuCl₆↓+ 5N₂↑+24H₂O + 8NH₃
钌可与次氯酸钠反应,从而回收废旧的钌:
Ru + 4NaClO ══△ RuO₄ + 4NaCl
早期的时候,人们使用吹灰法生产银,经过多次吹灰之后可得到高纯度的银:
Ag₂S + O₂ ══△ 2Ag + SO₂
在硝酸银溶液中可实现银的精炼:
Ag ══电解精炼 Ag
也可由与活泼金属组成原电池的方法得到金属银:
Cu + 2AgNO₃ ══ Cu(NO₃)₂ + 2Ag
稀土中部分元素的简易分离法最新版
混合冶金法
名称
混合冶金法
版权信息
版权归主
发明人
zumimvon | johanzumimvon | niomium(其实都是同一个人)
操作
五氧化二铌可以加入到氧化铁中,冶铁温度用氢气还原得到铌钢,也就是铌的铁溶液,从而避免粉末冶金法:
Nb₂O₅ + 5H₂ ══△ 2Nb + 5H₂O
Fe₂O₃ + 3H₂ ══△ 2Fe + 3H₂O
这就是混合冶金法,就是通过氢气还原氧化铁混合物直接得到固溶体,由于形成固体溶液(固溶体)可以像食盐水那样降低铁的熔点,所以可以直接使用现有工艺生产难熔金属合金,这样就可以节约大量的能源!
铁钼合金的生产方法:
MoO₃ + 3H₂ ══△ Mo + 3H₂O
Fe₂O₃ + 3H₂ ══△ 2Fe + 3H₂O
铁钽合金的生产方法:
Ta₂O₅ + 5H₂ ══△ 2Ta + 5H₂O
Fe₂O₃ + 3H₂ ══△ 2Fe + 3H₂O
混合冶金法可以使用发展中国家获得发达国家般的生产能力。
通过混合冶金法可生产铌三锡超导合金:
3Nb₂O₅ + 2SnO₂ + 19H₂ ══ 2Nb₃Sn + 19H₂O
对于锆、铪,则可以通过海绵锆、海绵铪融入到时铁水中熔炼。