元素周期表 - johanzumimvon/Johan-zumimvon-Christianity GitHub Wiki
如果只要专心学习教科书内容, 请见条目精简版元素周期表
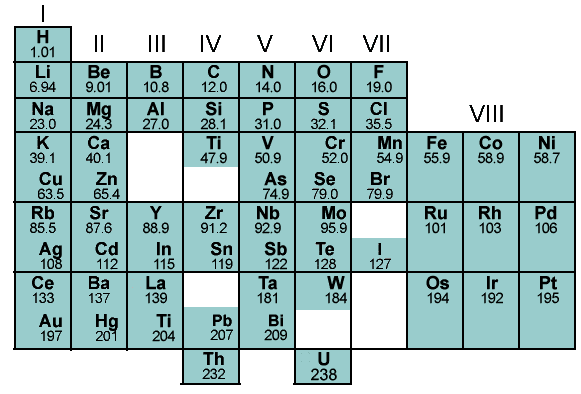
我设计的最新版元素周期表, 由于电脑的文件无法传送至手机, 因此只能發送拍照版.
其中, 蓝白色是金属元素; 黄色是普通非金属; 蓝绿色是稀有气体(考虑到相对论效应与自旋轨域耦合作用).
之所以到第120号元素モㇴコリュㇺ(Mm)为止, 是因为相对论效应与自旋轨域耦合作用的影响, モㇴコリュㇺ之後的化学元素已经不復适用元素周期律.

新式门捷列夫(メㇴデレーウ)怀旧版, 截止至第118号元素オガネソㇴ.

科学版, 截止至第118号元素オガネソㇴ.

サ゚ㇻ̲·チャ゙ネㇳ(Charles Janet)版, 截止至第120号元素モㇴコリュㇺ.
难以置信之事实
倘若没有基督教传来的普世价值思想(即人人平等、人的私有财产神圣不可侵犯), 我今天学的依然是四书五经、二十四孝、弟子规、百家姓、千字文、大乘佛经、禅宗语录等等, 中国人依然要在肏蛋般的朝代轮回中做儒释道顺民, 而不是接触到神奇的数理化. 即使是朝鲜也不比中国好多少.
你知道吗, 氦元素(ヘーリュㇺ)最早被传教士译作【氜】. 事实上, 基督教反对迷信, 基督教的传入加速了中国的民智启蒙.
基督教不仅给中国人带来了数理化知识, 还给中国人带来了自繇、平等等等普世价值, 消除了缠足等等陋俗.
民不畏死, 奈何以死相迫.
今朝忠汞迫害人民; 明天人民绝对不会放过清算忠汞.
感谢基督教的普世价值! アーメㇴ!

priodica
其中, 白蓝色的部分是金属元素(metallicus, メタㇻ̲リクㇲ); 黄色部分是非金属元素(nonmetallicus, ノㇴメタㇻ̲リクㇲ).


随着周期数的增加, 原子电子层增加, 同族元素的价电子距离原子核越来越远, 非金属之德减弱, 失电子之德增强.
结果导致随着周期的增加, 金属元素与非金属元素的界限嚮右偏移, 在元素周期表上表现呈锯齿图案.
也就是, 第一週期的元素都是非金属元素; 之後, 第n週期的金属元素的核外电子最多有n个: 铍2, 铝3, 锗4, 锑5, 钋6, 钿7.
钯属于金属元素
鎶应该属于非金属元素
| 周期 | 非金属界限 | 价电子数 | 对比 |
|---|---|---|---|
| 1 | 氢 | 1 | H₂O |
| 2 | 硼 | 3 | BeSO₄, Na[B(OH)₄] |
| 3 | 硅 | 4 | Al₂(SO₄)₃, Na₂SiO₃ |
| 4 | 砷 | 5 | Ge(SO₄)₂, NaAsO₂ |
| 5 | 碲 | 6 | Sb₂(SO₄)₃, Na₂TeO₄ |
| 6 | 砹 | 7 | Po(SO₄)₂, (AtO)₂SO₄ |
| 7 | 鿫 | 8 | (TsO)₂SO₄, Na₄OgO₄ |
也就是按照这个规律, 鿫之後没有任何非金属元素了. 如果考虑相对论效应, 则鿫之後的元素的化学性质更像贵金属.
另外由于次级周期律, 也就是钪系收缩、镧系收缩, 同族化学元素性质会有起伏, 比如镓的非金属性大于铝; 镥的非金属性大于钇.
事实上, 金属元素与非金属界限模糊, 比如硼是非金属元素, 却能形成磷酸硼BPO₄; 砹是非金属元素, 却能形成(AtO)₂SO₄; 镓是金属元素且镓在铝下边, 但镓能够形成Na[Ga(OH)₄]且难以被二氧化碳酸化.
非金属性指原子、分子或离子在化学反应中难以失去电子的能力. 难以失去电子的能力越强的粒子其非金属性也就越强; 反之则越弱. 除了稀有气体, 非金属性最强的元素是氟.
从左到右, 原子半径变小; 从上到下, 原子半径变大.
由原子单质的氧化性判断:
一般情况下, 单质氧化性越强, 对应元素非金属性越强.
由对应气态氢化物的稳定性判断: 气态氢化物越稳定, 非金属性越强.
由与氢气化合的难易程度判断: 化合越容易, 非金属性越强.
由最高价氧化物对应水化物的酸性来判断: 酸性越强, 非金属越强.
由置换反应判断: 强置弱. 〔若依据置换反应来说明元素的非金属性强弱,则非金属单质应做氧化剂,非金属单质做还原剂的置换反应不能作为比较非金属性强弱的依据〕
值得注意的是: 氟元素没有正价态, 故没有氟的含氧酸, 所以最高价氧化物对应水合物的酸性最强的是高氯酸, 而不是非金属性高于氯的氟元素. 本规律只适用于氟元素之外的非金属元素.
由对应阴离子的还原性判断: 还原性越强, 对应非金属性越弱.
在非金属元素的化合物中, 显负化合价的元素的非金属性较强.
按元素周期律, 同周期元素由左到右, 随核电荷数的增加, 非金属性增强;
同主族元素由上到下, 随核电荷数的增加, 非金属性减弱. 但也有例外: 铝, 镓; 钇, 镥.
| 名 | |
|---|---|
| 元素周期表 | ペリョ丌カ |
| 化学元素 | エレメㇴト゚ㇺ |
| 要素, 要点 | ヨソ |
| 金属单质 | カネ |
| 非金属单质 | ノㇴカネ |
| 金属元素 | メタㇻ̲リクㇲ |
| 非金属元素 | ノㇴメタㇻ̲リクㇲ |
| 非金属性 | ノㇴメタㇻ̲リクㇲトㇰ |
| 主族元素 | ツーチョㇰエレメㇴト゚ㇺ |
| 过渡元素 | 𰀪トエレメㇴト゚ㇺ |
| F区元素 | ヌイ𰀪トエレメㇴト゚ㇺ |
| 稀土 | ユㇳテㇻ̲ミト゚ㇺyttermidum |
| 镧系 | ラㇴサニト゚ㇺ |
| 锕系 | アㇰ丌ニト゚ㇺ |
| 钢 | ㇲ丌ーㇻ̲ |
| 合金 | アロイ |
原子序数超过172之时, 中性原子的1s能级的电子能量会低于1.02百万电子伏特, 这就导致库仑黑洞(Couromb black hole, クーロㇺクㇴネポルツㇷ゚)的产生, 也就是电子的逃逸遬度超过了光速, 从而使1s电子永远无法脱离其原子核, 亦导致裸原子核可氧化真空, 产生正电子(positron, ポシㇳロㇴ)与二体系统.
因此目前不清楚172号之後会發生何事.
有可能第172号元素之後的元素, 其裸原子核可以在氧化真空, 产生正负电子对, 其中电子进入库仑黑洞, 与原子核融合, 导致原子序数永远不会超过172.

在这张元素周期表中, 氢被排到硼上边而不是锂上边, 这是因为氢可以形成多中心分叉氢键, 比如颜料黄138中间的分叉氢键.

颜料黄138
| IA | IIA | IIIG | IVG | VG | VIG | VIIG | VIIIG | IXG | XG | XIG | XIIG | XIIIG | XIVG | XVG | XVIG | XVIIG | XVIIIG | IG | IIG | IIIC | IVC | VC | VIC | VIIC | VIIIC | IXC | XC | XIC | XIIC | XIIIC | XIVC | IC | IIC | IIIB | IVB | VB | VIB | VIIB | VIIIB | IXB | XB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 氢 | 氦 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 锂 | 铍 | 硼 | 碳 | 氮 | 氧 | 氟 | 氖 | ||||||||||||||||||||||||||||||||||||||||||
| 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 | ||||||||||||||||||||||||||||||||||||||||||
| 钾 | 钙 | 鍖 | 钛 | 钒 | 铬 | 锰 | 铁 | 钴 | 镍 | 铜 | 锌 | 镓 | 锗 | 砷 | 硒 | 溴 | 氪 | ||||||||||||||||||||||||||||||||
| 铷 | 锶 | 钇 | 锆 | 铌 | 钼 | 锝 | 钌 | 铑 | 钯 | 银 | 镉 | 铟 | 锡 | 锑 | 碲 | 碘 | 氙 | ||||||||||||||||||||||||||||||||
| 铯 | 钡 | 镧 | 铈 | 镨 | 钕 | 钷 | 钐 | 铕 | 钆 | 铽 | 镝 | 钬 | 铒 | 铥 | 镱 | 镥 | 铪 | 钽 | 钨 | 铼 | 锇 | 铱 | 铂 | 金 | 汞 | 铊 | 铅 | 铋 | 钋 | 砹 | 氡 | ||||||||||||||||||
| 钫 | 镭 | 锕 | 钍 | 镤 | 铀 | 镎 | 钚 | 镅 | 锔 | 锫 | 锎 | 锿 | 镄 | 钔 | 锘 | 铹 | 𬬻 | 𬭊 | 𬭳 | 𬭛 | 𬭶 | 鿏 | 𫟼 | 𬬭 | 鿔 | 鿭 | 𫓧 | 镆 | 𫟷 | 钿 | 鿫 | ||||||||||||||||||
| Uy | Ay | 123 | 124 | 125 | 鍏 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | 143 | 144 | 145 | 146 | 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 | 161 | 162 | 163 | 164 | ||||||
| 165 | 166 | 167 | 168 | 169 | 170 | 171 | 鏾 |
其中, 第165号元素~第168号元素进入第九周期.
鿔可被视为过渡元素中惟一的非金属元素, 请见数理化札记112
由于进入第八周期之後, 元素性质不会有大的突变, 因此鿫之後的元素被单独列到27·2的表格中, 以便于阅读.
| IA | IIA | IIIC | IVC | VC | VIC | VIIC | VIIIC | IXC | XC | XIC | XIIC | XIIIC | XIVC | IC | IIC | IIIB | IVB | VB | VIB | VIIB | VIIIB | IXB | XB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 氢 | 氦 | ||||||||||||||||||||||||||||||
| 锂 | 铍 | 硼 | 碳 | 氮 | 氧 | 氟 | 氖 | ||||||||||||||||||||||||
| 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 | ||||||||||||||||||||||||
| 钾 | 钙 | 鍖 | 钛 | 钒 | 铬 | 锰 | 铁 | 钴 | 镍 | 铜 | 锌 | 镓 | 锗 | 砷 | 硒 | 溴 | 氪 | ||||||||||||||
| 铷 | 锶 | 钇 | 锆 | 铌 | 钼 | 锝 | 钌 | 铑 | 钯 | 银 | 镉 | 铟 | 锡 | 锑 | 碲 | 碘 | 氙 | ||||||||||||||
| 铯 | 钡 | 镧 | 铈 | 镨 | 钕 | 钷 | 钐 | 铕 | 钆 | 铽 | 镝 | 钬 | 铒 | 铥 | 镱 | 镥 | 铪 | 钽 | 钨 | 铼 | 锇 | 铱 | 铂 | 金 | 汞 | 铊 | 铅 | 铋 | 钋 | 砹 | 氡 |
| 钫 | 镭 | 锕 | 钍 | 镤 | 铀 | 镎 | 钚 | 镅 | 锔 | 锫 | 锎 | 锿 | 镄 | 钔 | 锘 | 铹 | 𬬻 | 𬭊 | 𬭳 | 𬭛 | 𬭶 | 鿏 | 𫟼 | 𬬭 | 鿔 | 鿭 | 𫓧 | 镆 | 𫟷 | 钿 | 鿫 |
| Ci | Mm | Uy | Ay | 123 | 124 | 125 | Hn | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | 143 | 144 | 145 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 146 | 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 | 161 | 162 | 163 | 164 | 165 | 166 | 167 | 168 | 169 | 170 | 171 | 172 |

右阶元素周期表又名右式元素周期表, 全部如下:
| 氢 | 氦 | ||||||||||||||||||||||||||||||
| 锂 | 铍 | ||||||||||||||||||||||||||||||
| 硼 | 碳 | 氮 | 氧 | 氟 | 氖 | 钠 | 镁 | ||||||||||||||||||||||||
| 铝 | 硅 | 磷 | 硫 | 氯 | 氩 | 钾 | 钙 | ||||||||||||||||||||||||
| 鍖 | 钛 | 钒 | 铬 | 锰 | 铁 | 钴 | 镍 | 铜 | 锌 | 镓 | 锗 | 砷 | 硒 | 溴 | 氪 | 铷 | 锶 | ||||||||||||||
| 钇 | 锆 | 铌 | 钼 | 锝 | 钌 | 铑 | 钯 | 银 | 镉 | 铟 | 锡 | 锑 | 碲 | 碘 | 氙 | 铯 | 钡 | ||||||||||||||
| 镧 | 铈 | 镨 | 钕 | 钷 | 钐 | 铕 | 钆 | 铽 | 镝 | 钬 | 铒 | 铥 | 镱 | 镥 | 铪 | 钽 | 钨 | 铼 | 锇 | 铱 | 铂 | 金 | 汞 | 铊 | 铅 | 铋 | 钋 | 砹 | 氡 | 钫 | 镭 |
| 锕 | 钍 | 镤 | 铀 | 镎 | 钚 | 镅 | 锔 | 锫 | 锎 | 锿 | 镄 | 钔 | 锘 | 铹 | 𬬻 | 𬭊 | 𬭳 | 𬭛 | 𬭶 | 鿏 | 𫟼 | 𬬭 | 鿔 | 鿭 | 𫓧 | 镆 | 𫟷 | 钿 | 鿫 | Ci | Mm |
| Uy | Ay | 123 | 124 | 125 | Hn | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | 143 | 144 | 145 | 146 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 | 161 | 162 | 163 | 164 | 165 | 166 | 167 | 168 | 169 | 170 | 171 | 172 |
二维元素周期表, 当初是根据二维世界的物理学定律作出的元素周期表, 又名二维元素周期律.
二维元素周期律

二维元素周期表之形式
| 1 | 2 | ||||||||||||||||
| 3 | 4 | 5 | 6 | 7 | 8 | ||||||||||||
| 9 | 10 | 11 | 12 | 13 | 14 | ||||||||||||
| 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | ||||||||
| 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | ||||||||
| 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | ||||
| 49 | 50 | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 | 61 | 62 | ||||
| 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 |
| 81 | 82 | 83 | 84 | 85 | 86 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 |
其对映物为
| CH₃ | CH₂═CH₂ | ||||||||||||||||
| 3 | 4 | C₃H₃ | 环丁二烯 | 茂 | ⌬ | ||||||||||||
| 9 | 10 | 11 | 12 | 13 | 14 | ||||||||||||
| 15 | 16 | 䓬 | 环辛四烯 | 茚 | 萘 | 21 | 22 | 23 | 24 | ||||||||
| 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | ||||||||
| 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | ||||
| 49 | 50 | 51 | 52 | 53 | 芘 | 55 | 56 | 57 | 58 | 59 | 60 | 61 | 62 | ||||
| 63 | 64 | 65 | 66 | 67 | 酞菁环中心 | 69 | 70 | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 |
| 81 | 82 | 83 | 84 | 85 | 蒄 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 |
芘虽然有14个电子, 但蒄只有二个电子层且可看作2+14, 所以芘成了第54号元素.
蒄虽然有24个电子, 但蒄只有二个电子层且可看作6+18, 所以寇成了第86号元素.
酞菁中间的环虽然有18个电子(加上四个苯环则是54个电子), 但是酞菁平面原子中间的环只有一层电子层, 外边有独立的四个6电子电子层, 因此酞菁被归类为第68呈元素.
将物理学推导的二维元素周期表中的第1、2、5、6、7、8、17、18、19、20、37、38、39、40、65、66、67、68号元素单独取出, 可得到二维芳香周期表(hückelperiodica, (4n−2)周期表) 对于普通的芳香性体系, 其可以用二维元素周期律表示:
| 平钠族 | 平氧族 | 平氯族 | 平氖族 |
|---|---|---|---|
| 甲基 | 乙烯 | ||
| C₃H₃ | 环丁二烯 | 茂自繇基 | ⌬、吡咯 |
| 䓬自繇基 | 环辛四烯 | 茚自繇基 | 萘 |
| 芘的最外层 | |||
| 酞菁环原 | 酞菁环 |
芘二维原子的第一层是◊H; 第二层电子层是◊Kr, 所以芘具有芳香性.
经过形式化之後则是
芳香二维元素周期表 aromatuperiodica | アロマト゚ベリオ丌゙カ
| 平钠族 | 平氧族 | 平氯族 | 平氖族 |
|---|---|---|---|
| 平氢◊H | 平氦◊He | ||
| 平氮◊N | 平氧◊O | 平氟◊F | 平氖◊Ne |
| 平钠◊Na | 平镁◊Mg | 平氯◊Cl | 平氩◊Ar |
| 平钾◊K | 平钙◊Ca | 平溴◊Br | 平氪◊Kr |
| 平铷◊Rb | 平锶◊Sr | 平碘◊J | 平氙◊Xe |
对于3个p轨域的6个电子, 其可分为能量更低的2电子与能量更高的4电子;
对于5个d轨域的10个电子, 其可分为能量低的2电子、能量中的4电子与能量高的4电子;
对于7个f轨域的14个电子, 其可分为能量最低的2电子、能量低的4电子、能量高的4电子与能量最高的4电子;
这就使得镧系元素具有多种多样的光学性质.
因为四维空间存在双旋转现象, 考虑到四种自旋的四维元素周期表
四维世界第十一集: 元素周期表
这次我们来看看四维世界中的微观理论之元素周期律.
四维原子结构一直是一件麻烦事____力的三次方反比衰减规律导致原子定态波函数不存在, 科学界都公认四维世界中不可能有原子, 也不可能构成物质, 本文遂结束矣. 除了直接接受这个残酷现实, 其实还是可以假设有四维世界原子, 但其量子力学具体机制肯定大不同于三维理论.
为了尽量保持跟我们世界的相似性, 如果暂且不管力的三次方反比衰减规律, 假设波函数在超球面各方向上的分布还是满足波动规律, 则还是可以保留原子的电子亚层结构、元素周期律与分子结构, 不足的就是电离能、活泼性、光谱等涉及整体能量等需要涉及径向方向的计算问题就完全无法预知结果了. 所以, 本文包括整个四维世界系列在内的科学性大打折扣, 仅供娱乐与提供写小说等思路, 请勿较真.
氢、氦填充第一电子层.
到了锂元素, 能量最小的轨道被填满了, 多出来的电子只能挤进下一层____第二电子层.
电子是从低能量轨域开始填充, 且满足泡利原理、hund规则.
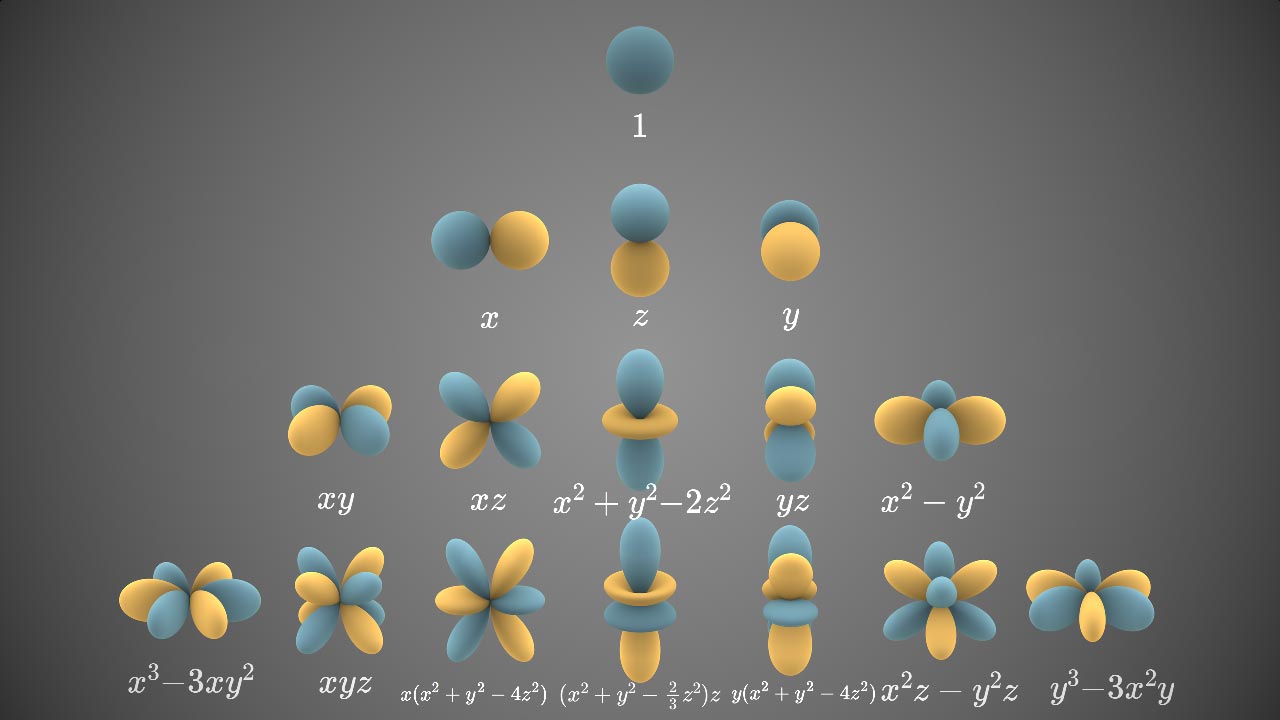
其中, (x²+y²)可以简化作r², 即
x²+y²=r²
这样的话, 3d轨道中间带环的就是(r²−2z²)
四量子数
主量子n
n=1, 第一电子层, K层;
n=2, 第二电子层, L层;
n=3, 第三电子层, M层;
n=4, 第四电子层, N层;
n=5, 第五电子层, O层;
n=6, 第六电子层, P层;
n=7, 第七电子层, Q层;
n=8, 第八电子层, R层;
n=9, 第九电子层, S层不是s能级
角量子数l
l=0, s轨道;
l=1, p轨道;
l=2, d轨道;
l=3, f轨道;
l=4, g轨道.
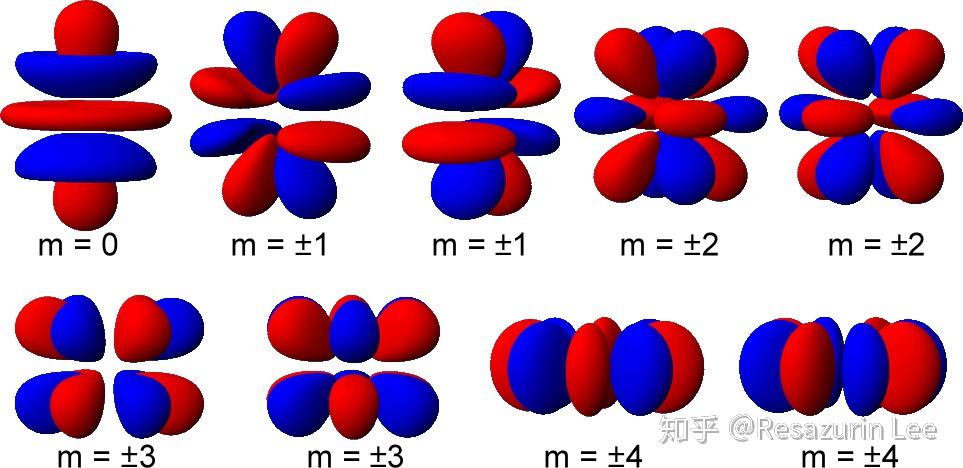
磁量子数
| 轨域 | 种类 |
|---|---|
| s | 1 |
| p | x, y, z |
| d |
|
在三维空间中, 同一电子层,
s轨域有1个, 最多可容纳2电子;
p轨域有3个, 最多可容纳6电子;
d轨域有5个, 最多可容纳10电子;
f轨域有7个, 最多可容纳14电子;
g轨域有9个, 最多可容纳18电子;
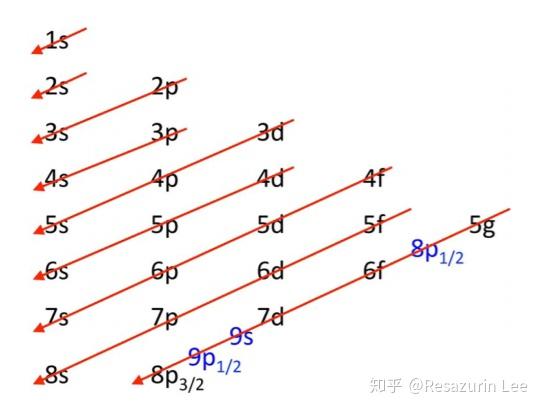
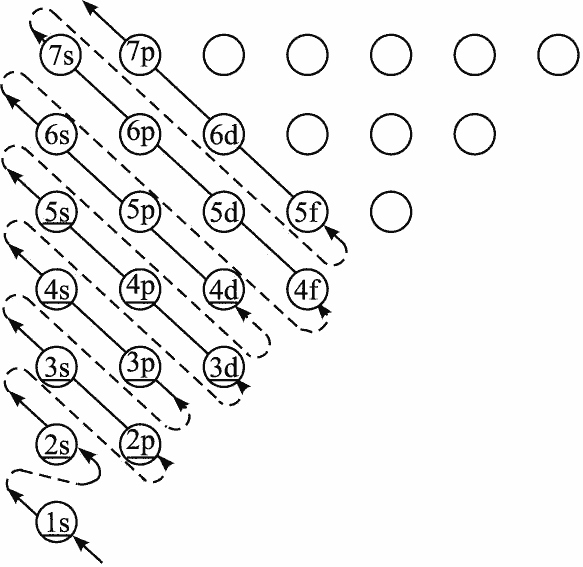
且考虑到同电荷排斥, 最外层会出现能级交错, 比如
对于第四周期, 先填充距离原子核更远但负电荷密度更小的4s能级, 之後才是3d能级. 到了铜与铜之後的元素, 能级交错结束, 3d能级遂的能量低于4s能级.
不考虑相对论效应和轨道宽阔形状因素第五周期过渡元素的话, 能级的填充顺序是
| 周期 | 能级 | 数目 |
|---|---|---|
| 1 | 1s | 2 |
| 2 | 2s,2p | 2+6=8 |
| 3 | 3s,3p | 2+6=8 |
| 4 | 4s,3d,4p | 2+10+6=18 |
| 5 | 5s,4d,5p | 2+10+6=18 |
| 6 | 6s,4f,5d,6p | 2+14+10+6=32 |
| 7 | 7s,5f,6d,7p | 2+14+10+6=32 |
| 8 | 8s,5g,6f,7d,8p | 2+18+14+10+6=50 |
有了能级交错原理, 继续按顺序填电子下去就可以解释为什么有主族、副族和镧系(lanthanidum)、锕系(actinidum)、钞系(zaunidum). 总之,给定角量子数为l, 就存在(2l+1)个简并轨道, 即每个电子层有最多有1个s轨道、3个p轨道、5个d轨道、7个f轨道、9个g轨道. 相信大家对三维周期表已经比较熟悉了.
在继续看四维前, 我们先来看看更简单的二维世界中的元素周期律来加深理解这其中的原理.
士大夫评论
| 1 | 2 | ||||||||||||||||
| 3 | 4 | 5 | 6 | 7 | 8 | ||||||||||||
| 9 | 10 | 11 | 12 | 13 | 14 | ||||||||||||
| 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | ||||||||
| 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | ||||||||
| 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | ||||
| 49 | 50 | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 | 61 | 62 | ||||
| 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 |
| 81 | 82 | 83 | 84 | 85 | 86 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 |
研究芳香化合物也得到了类似的结论, 只不过芳香化合物的电子层比较局限, 比如蒄coronene, コロネㇴ只有二个电子层而不是二维原子的八层或者九层电子层.

虽然这让我很伤心, 但蒄依然有一点二维元素周期律的调调.
二维世界中没有氮元素, 碳过了直接就是氧.
碳最外层只有3个电子, 离6电子稳定结构还差3个, 因此甲烷是CH₃而不再是CH₄. 同理, 乙烯的结构是直线型的H─C═C─H, 不再有三键的乙炔存在.
除了碳酸之外, 不再存在其它的有机酸了.
对于醛类也是, 只有甲醛没有乙醛了.
氧原子倒是没什么变化, 水还是H₂O.
氟元素及其它卤素不怎么受维度影响, 跟三维的差不多.
终于轮到四维了. 上一篇文章介绍的有亿点复杂的超球谐函数也总算可以开始为我们服务了. 按照角量子数在超球各经纬线上的波动规律, 我们可以得到不同亚层的简并轨道个数:
s只有一个轨道;
p有四个, 分别朝向四个维度
d有9;
f有16
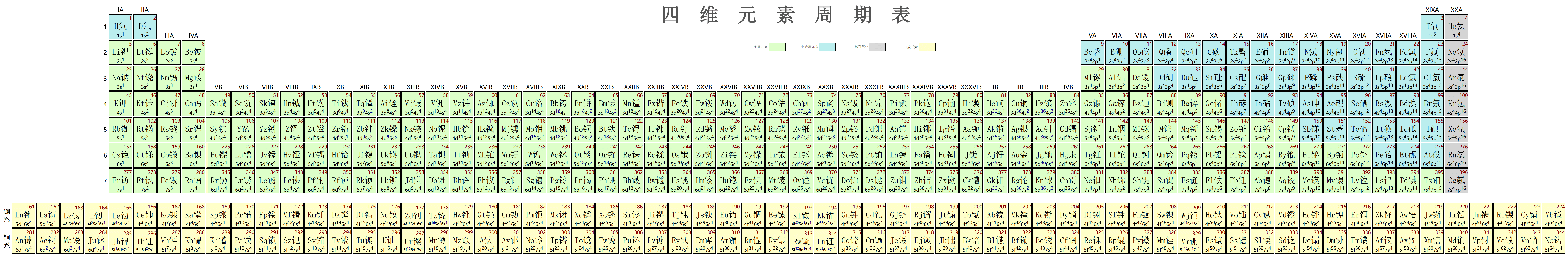
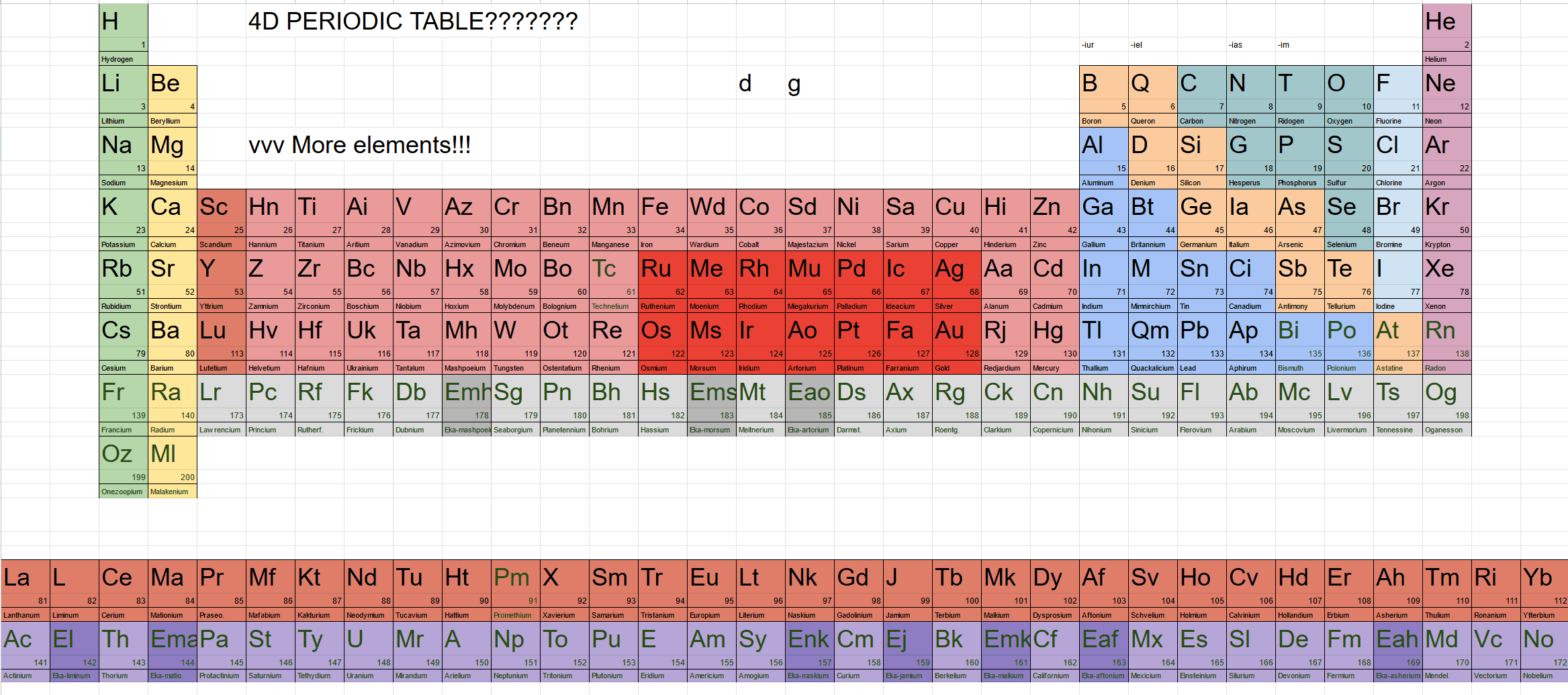
一般角量子数为l, 则它有l²个轨道. 掌握了这个规律后, 就完全能够按照能级交错规律就能画出四维元素周期表了. 昇空论坛上有人提出了四维元素周期表, 他放了一个表格的截图, 并为每种元素都命了名, 取了元素符号:
昇空论坛上的四维元素周期表
从这个周期表来看, 四维元素的周期表跟三维的很像, 只是主族多了两列, 副族多得更长了, 而锕系、镧系更加长得不得了, 这是p、d与f轨道数量更多导致的.
常见化合物
对于四维世界的碳原子的东西最外层只有5个电子, 充满最多要10个, 所以还多了一种烃. 我将碳碳单键的烃还是叫烷烃, 它是五胞体构型的分子, 为sp⁴杂化; 双键的结构我选择了“烜”(シャ̅ㇴ55, süan55)这个字, 它读音切于烷与烯, 表示介于烷与烯之间的新烃类, 它的分子构型是正四面体型, 垂直于四面体胞的两侧有两个未参与sp³杂化的孤电子对; 三键的结构则反而类似平面正三角形的烯类, 采用sp²杂化, 它有两对互相垂直的孤电子对, 位于正三角形绝对垂直的平面上. 最后直线型的是四键的乙炔, 为sp杂化.
注意: 元素E(硝)在Higher Space论坛上称为N; 元素氮才称为T 刚才我们看到了五价的碳元素. 除了一价、二价、三价的氟、氧、氮元素, 四维最大的亮点是在碳和氮之间还多了一种四价元素, 我最先称之为“砃”,但后来突然想到含氮的化合物一般都叫“硝”, 干脆把“硝”作为新元素的名称该元素在Higher Space论坛上称为N,氮元素才称为T, 它的化合价为四价, 而但元素的化合价. 为什么说它像氮而不是碳呢?因为它最外层有6个电子, 还差4个电子达到稳定的全充满结构, 最多成四个键, 还剩下一个本来就充满的孤电子对, 这一点上确实更像氮而不像碳. 根据价电子互斥理论我们还能够预测水分子是折线形、氮氨是三角锥形、硝氨是四面体锥形、甲烷是正五胞体形……
本来我是打算继续探究苯、氨基酸、脱氧核糖核苷酸等更复杂的有机物的结构的, 但我突然想到, 四维具有的双旋转效应会不会让电子的自旋状态不再是只有上下两个方向呢? 如果是那样, 刚才的元素周期表就全部是错的, 刚才的分子结构也全错了. 为了搞清楚四维电子到底怎么自旋, 我们将深入到量子场论中描述电子运动的狄拉克方程, 去探究电子自旋的秘密. 这部分对物理学与数学的要求比较高, 我将它放入选读中, 读者完全可以跳过直接看结论.
二维世界中电子的自旋
二维世界的电子自旋只有二种:
三维世界中电子的自旋
我们的世界中, 电子的自旋一直都是个神秘的现象. 类似地球绕太阳旋转有公转自转, 电子分别有轨道角动量和自旋角动量. 轨道角动量就是电子的波函数在绕着原子核旋转(p、d、f、g轨道都有), 自旋角动量则像是电子的自转. 电子是基本粒子, 本质上就是一个点, 如何感知它在自转呢? 探测带电物体自转产生的磁矩即可.
在量子力学中,粒子的位置r和动量p不能同时确定, 而轨道角动量l=rp正好由二个在精确度上相悖的量组成, 导致测量角动量时只能同时测量到角动量的总大小和某个方向上的角动量分量但不能同时测量角动量的所有分量, 因为它们也会像同时确定位置和动量那样变得不确定.
自旋角动量就更奇怪了: 它除了跟轨道角动量有一样的规律(即能同时测量哪些量、不能同时测量哪些量), 其它就跟位置空间上的波函数没有任何关联了, 类似于地球的自转朝向跟其在宇宙中的位置是没关联的. 因此除了空间波函数, 还需要专门引入一种“内部空间”的量子态来描述自旋状态.
电子自旋的量子态到底是什么样子的呢? 大家都知道电磁场是矢量场, 它也有轨道角动量和自旋角动量: 当我们旋转整个空间时, 肯定是电磁场在空间中的位置(对应轨道角动量)跟箭头的指向(对应自旋角动量)一起旋转, 而不会单独旋转其中之一. 电子的自旋也类似于向量箭头, 它们都遵循在旋转变换下也跟着变换的这个规则. 通过研究旋转群的群表示论可以得出: 要想满足旋转变换规则, 要么这个东西像个标量(即与旋转无关,一直不变), 要么像个向量(像电磁场那样), 要么像一些高阶张量(比如引力子像对称二阶张量, 类似一个椭圆形, 旋转180度后就复原), 还可能像旋量____我们在几何代数中介绍过的东西____它在空间旋转360度后符号会反向. 人们发现电子的自旋正遵循旋量的变换规律.
当时的人们是通过原子光谱中出现二条很近的光谱谱线的现象来得知电子的自旋磁矩的, 并且也说明了电子的自旋角动量分量只能取离散的二个值. 科学家泡利弄出了三个“泡利矩阵”, 将泡利矩阵乘上
z方向已经是对角矩阵了, 说明这两个量子态正好就是z轴自旋角动量的本征态. 现在看起来z轴好像很特殊. 其实不然, 我们将介绍旋量的旋转变换规则, 它允许我们把任意方向都旋转到z轴上从而消灭其特殊性.
x方向矩阵
| ロ | 𝍩 |
|---|---|
| 𝍩 | ロ |
| 0 | 1 |
|---|---|
| 1 | 0 |
y方向矩阵
| 0 | \/𝍩 |
|---|---|
| /𝍩 | 0 |
| 0 | −i |
|---|---|
| i | 0 |
z方向矩阵
| 𝍩 | 0 |
|---|---|
| 0 | \𝍩 |
| 1 | 0 |
|---|---|
| 0 | −1 |
四维的4个p轨道渐次填入16个电子
现在可以对四维原子中的电子自旋下结论了, 它确实有左等角“上”、“下”与右等角“上”、“下”四种态. 且电子还是费米子. 根据泡利不相容原理, 同一状态下的费米子所有的量子数不能完全相同, 因此一个原子轨道能塞4个电子, 相比与二维和三维一个轨道两个电子, 周期表的长度会翻倍:
对于核壳层模型, 其满壳层的元素有
氦, 碳, 氧, 硅, 硫, 氩, 钙, 铁, 镍, 硒, 锶, 锆, 锡, 铈, 钐, 钆, 镝, 镱, 汞, 铅, 钍, 铀, 钚, 锔, 镄, 鿔, hanpokium | ハㇴポキュㇺ有人认为幻数126仅适用于中子数
比如说, ⁹⁰Zr的原子核有40质子与50中子, 可以被看作锆锡核, 也就是⁹⁰Zr的质子、中子各填满也自身壳层.
质子数或者中子数为
2, 6, 8, 14, 16, 18, 20, 26, 28, 34, 38, 40, 50, 58, 62, 64, 66, 70, 80, 82, 90, 92, 94, 96, 100, 112, 126
其中, 强幻数元素有
氦 氧 钙 镍 锆 锡 钆 铅 钍
核壳层模型导致一系列稳定岛的出现, 即稳定群岛:
氢元素~钼元素: 本半岛
钌元素~钕元素: 锡岛(50)
钐元素~钽元素: 钆岛(64)
铱元素~铋元素: 铅岛(82)
镭元素~镄元素: 钍岛(90、92)
鎶元素: 鎶岛(112)



碳原子核可以被看作3个氦原子核的结团;
氮原子核可以被看作3个氦原子核与1个氘原子核的结团;
氧原子核可以被看作4个氦原子核的结团
氧的富中子核素¹⁸O(重氧)的原子核可以被看作3个氦原子核与1个⁶He原子核的结团, 或者4个氦原子核与2个中子的结团;
²²Ne(重氖)的原子核可以被看作4个氦原子核与1个⁶He原子核的结团, 或者5个氦原子核(类比; 夸克, 𰀪ㇰ)与2个中子(类比; 胶子)的结团;
镁原子核可以被看作6个氦原子核的结团; 或者二个碳原子核的结团;
硅原子核可以被看作7个氦原子核的结团; 或者一个碳原子核与与一个氧原子核的结团;
硫原子核可以被看作8个氦原子核的结团; 或者2个氧原子核的结团;
氩38(中氩)可以被看作2个氧原子核与一个⁶He原子核的结团
原子核的质量数愈大, 则原子核越能允许容纳更多中子: 比如对于无法单独存在的⁶He, 其可以在重氧、重氖、中氩的原子核中得以稳定.
イケダ模型仅仅适用于钙20(轻钙, 可被看作10个氧原子核的结团, 从而导致其被目前认为无法發生双电子衰变)以内的化学元素.
钙元素是第一个使イケダ模型失效的化学元素.
液滴模型认为, 原子核中的质子与中子紧紧相邻, 构成一大团流动的液珠, 其中核力充当原子核的表面张力.
液滴模型认为, 原子序数为29的元素铜的原子核稳定性最高, 随着原子序数(质子数)的增加, 原子核的稳定性愈来愈弱, 从而导致放射性的产生.
液滴模型的缺陷很大, 因为质子、中子是费米子(fermion, フェㇻ̲ミョㇴ), 液滴模型忽略了质子、中子的泡利原理(パウリ原理).
比如¹⁵⁶钆的原子核就比¹⁴⁴钕更大, 但¹⁴⁴钕具有α放射性, 而¹⁵⁶钆是稳定核素; 又比如¹⁸⁶锇具有放射性, 反而原子核更大汞没有放射性; 砹、氡、钫的半衰期短得可怜, 但是拥有更大的原子核的钍、铀的半衰期长达百亿年、五十亿年.
如果把原子核看成是经典的带电液滴, 当质子数达到104左右时, 原子核的裂变位垒几乎消失, 輒无法阻挡原子核发生裂变.
如果液滴模型成立的话, 那么第104号元素𬬻(Rutherfordium, ルセォーフォー丌゙ュㇺ, 又名ekahafnium, エカハㇷニュㇺ)将无法存在; 但事实上人们發现了第118号元素オガネソㇴ.
为了便于在讨论这些化学元素的理化性质, 我给这些鿫之後的某些性质简易的元素了名称.
| 序 | 名称 | 符号 |
|---|---|---|
| 119 | コレニュㇺ | Ci |
| 120 | モㇴコリュㇺ | Mm |
| 121 | ウイウリュㇺ | Uy |
| 122 | アㇻ̲タユㇺ | Ay |
| 126 | ハㇴポキュㇺ | Hn |
交互式元素周期表, 是指可以与使用者互动的元素周期表.

元素丰度, 我在图中设置使用黄蓝对比色, 以便于色盲阅读.

元素熔点, 我将其设置为使用更加符合热辐射规律的配色方式____低温黄, 高温蓝____且依然使用黄色与蓝色, 以便于色盲者阅读.

我设置的配色的元素沸点.