数理化札记172: 精简版元素周期表 - johanzumimvon/1 GitHub Wiki
| IA | IIA | IIIC | IVC | VC | VIC | VIIC | VIIIC | IXC | XC | XIC | XIIC | XIIIC | XIVC | IC | IIC | IIIB | IVB | VB | VIB | VIIB | VIIIB | IXB | XB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 氢 | 氦 | ||||||||||||||||||||||||||||||
| 锂 | 铍 | 硼 | 碳 | 氮 | 氧 | 氟 | 氖 | ||||||||||||||||||||||||
| 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 | ||||||||||||||||||||||||
| 钾 | 钙 | 鍖 | 钛 | 钒 | 铬 | 锰 | 铁 | 钴 | 镍 | 铜 | 锌 | 镓 | 锗 | 砷 | 硒 | 溴 | 氪 | ||||||||||||||
| 铷 | 锶 | 钇 | 锆 | 铌 | 钼 | 锝 | 钌 | 铑 | 钯 | 银 | 镉 | 铟 | 锡 | 锑 | 碲 | 碘 | 氙 | ||||||||||||||
| 铯 | 钡 | 镧 | 铈 | 镨 | 钕 | 钷 | 钐 | 铕 | 钆 | 铽 | 镝 | 钬 | 铒 | 铥 | 镱 | 镥 | 铪 | 钽 | 钨 | 铼 | 锇 | 铱 | 铂 | 金 | 汞 | 铊 | 铅 | 铋 | 钋 | 砹 | 氡 |
| 钫 | 镭 | 锕 | 钍 | 镤 | 铀 | 镎 | 钚 | 镅 | 锔 | 锫 | 锎 | 锿 | 镄 | 钔 | 锘 | 铹 | 𬬻 | 𬭊 | 𬭳 | 𬭛 | 𬭶 | 鿏 | 𫟼 | 𬬭 | 鿔 | 鿭 | 𫓧 | 镆 | 𫟷 | 钿 | 鿫 |

最新版元素周期表
我设计的最新版元素周期表, 由于电脑的文件无法传送至手机, 因此只能發送拍照版.
其中, 蓝白色是金属元素; 黄色是普通非金属; 蓝绿色是稀有气体(考虑到相对论效应与自旋轨域耦合作用).

新式门捷列夫(メㇴデレーウ)怀旧版, 截止至第118号元素オガネソㇴ.

科学版, 截止至第118号元素オガネソㇴ.

priodica
其中, 白蓝色的部分是金属元素(metallicus, メタㇻ̲リクㇲ); 黄色部分是非金属元素(nonmetallicus, ノㇴメタㇻ̲リクㇲ).


随着周期数的增加, 原子电子层增加, 同族元素的价电子距离原子核越来越远, 非金属之德减弱, 失电子之德增强.
结果导致随着周期的增加, 金属元素与非金属元素的界限嚮右偏移, 在元素周期表上表现呈锯齿图案.
也就是, 第一週期的元素都是非金属元素; 之後, 第n週期的金属元素的核外电子最多有n个: 铍2, 铝3, 锗4, 锑5, 钋6, 钿7.
钯属于金属元素
鎶应该属于非金属元素
| 周期 | 非金属界限 | 价电子数 | 对比 |
|---|---|---|---|
| 1 | 氢 | 1 | H₂O |
| 2 | 硼 | 3 | BeSO₄, Na[B(OH)₄] |
| 3 | 硅 | 4 | Al₂(SO₄)₃, Na₂SiO₃ |
| 4 | 砷 | 5 | Ge(SO₄)₂, NaAsO₂ |
| 5 | 碲 | 6 | Sb₂(SO₄)₃, Na₂TeO₄ |
| 6 | 砹 | 7 | Po(SO₄)₂, (AtO)₂SO₄ |
| 7 | 鿫 | 8 | (TsO)₂SO₄, Na₄OgO₄ |
也就是按照这个规律, 鿫之後没有任何非金属元素了. 如果考虑相对论效应, 则鿫之後的元素的化学性质更像贵金属.
另外由于次级周期律, 也就是钪系收缩、镧系收缩, 同族化学元素性质会有起伏, 比如镓的非金属性大于铝; 镥的非金属性大于钇.
事实上, 金属元素与非金属界限模糊, 比如硼是非金属元素, 却能形成磷酸硼BPO₄; 砹是非金属元素, 却能形成(AtO)₂SO₄; 镓是金属元素且镓在铝下边, 但镓能够形成Na[Ga(OH)₄]且难以被二氧化碳酸化.
非金属性指原子、分子或离子在化学反应中难以失去电子的能力. 难以失去电子的能力越强的粒子其非金属性也就越强; 反之则越弱. 除了稀有气体, 非金属性最强的元素是氟.
除了钯原子, 第n周期的元素的原子, 有n个电子壳层(electron shell, エレㇰチョㇴ层).
电子层从K开始按字母顺序编号: K(カー, 第一层), L(エレ, 第二层), M(エメ, 第三层), N(エネ, 第四层), O(オー, 第五层), P(ペー, 第六层), Q(クー, 第七层), R(エレ, 第八层), S(エセ, 第九层)
需要注意的是, 到了鍖元素(scandium, ㇲカㇴ丌゙ュㇺ, 钪), 3d电子(不是空轨道)的能量开始低于4s电子, 也就是对于过渡元素, 先失去ns电子, 然後失去(n−d)电子.
第四周期的钾、钙之所以先填充第四电子层, 到了鍖~锌元素才回头填充第三电子层, 是因为同种电荷相互排斥, 一开始填充第四层反而受到的排斥能更小, 在能量上更有利, 直到从鍖元素开始, 原子核的核电荷数足够大, 足以抵消其抗力, 遂开始填充3d能级, 其中填充电子的部分能量开始低于4s能级, 到了铜元素, 3d能级填满且彻底低于4s能级.
比如说, 鍖(Sc, [Ar]3d¹4s²), 从Sc³⁺到中性的Sc, 先是填充3d, 之後由于第三层(M层)的斥力过大而将二电子填入4s能级.
铁, 从Fe⁸⁺到中性的Fe, 先是6电子填入3d能级, 之後M层斥力变大, 2电子遂填入4s能级.
铜, 从Cu¹¹⁺到中性的铜, 先是10电子填入3d直到全充满, 然後填入4s能级.
与鲍林(Pauling, ハォリョン゚)能级相比, カォトㇴ能级更为科学.
カォトㇴ能级能很好地反映能级能量与电子的关系.
| 元素 | 从低到高的能级顺序 |
|---|---|
| 氢 | 1s |
| 氦 | 1s |
| 锂 | 1s,2s |
| 铍 | 1s,2s |
| 硼 | 1s,2s,2p |
| 碳 | 1s,2s,2p |
| 氮 | 1s,2s,2p |
| 氧 | 1s,2s,2p |
| 氟 | 1s,2s,2p |
| 氖 | 1s,2s,2p |
| 钠 | 1s,2s,2p,3s |
| 镁 | 1s,2s,2p,3s |
| 铝 | 1s,2s,2p,3s,3p |
| 硅 | 1s,2s,2p,3s,3p |
| 磷 | 1s,2s,2p,3s,3p |
| 硫 | 1s,2s,2p,3s,3p |
| 氯 | 1s,2s,2p,3s,3p |
| 氩 | 1s,2s,2p,3s,3p |
| 钾 | 1s,2s,2p,3s,3p,4s,3d |
| 钙 | 1s,2s,2p,3s,3p,4s,3d |
| 鍖 | 1s,2s,2p,3s,3p,3d,4s |
| 钛 | 1s,2s,2p,3s,3p,3d,4s |
| 铁 | 1s,2s,2p,3s,3p,3d,4s |
| 钴 | 1s,2s,2p,3s,3p,3d,4s |
| 镍 | 1s,2s,2p,3s,3p,3d,4s |
| 铜 | 1s,2s,2p,3s,3p,3d,4s |
| 锌 | 1s,2s,2p,3s,3p,3d,4s |
| 镓 | 1s,2s,2p,3s,3p,3d,4s,4p |
| 锗 | 1s,2s,2p,3s,3p,3d,4s,4p |
| 砷 | 1s,2s,2p,3s,3p,3d,4s,4p |
| 硒 | 1s,2s,2p,3s,3p,3d,4s,4p |
| 溴 | 1s,2s,2p,3s,3p,3d,4s,4p |
| 氪 | 1s,2s,2p,3s,3p,3d,4s,4p |
| 铷 | 1s,2s,2p,3s,3p,3d,4s,4p,5s,4d |
| 锶 | 1s,2s,2p,3s,3p,3d,4s,4p,5s,4d |
| 钇 | 1s,2s,2p,3s,3p,3d,4s,4p,5s,4d |
| 钯 | 1s,2s,2p,3s,3p,3d,4s,4p,4d,5s |
| 银 | 1s,2s,2p,3s,3p,3d,4s,4p,4d,5s |
| 氙 | 1s,2s,2p,3s,3p,3d,4s,4p,4d,5s,5p |
F>O>N≥Cl>Br>I>S>Se>C>H>P>B>Si
氟氧氮之司空见惯
氯溴碘之哈喽(halogenum, ハロゲヌㇺ)三杰
硫硒二位硫族人士
碳氢二位有機大夫
磷让化学更有气兮(创世纪造人的泥土)
硼硅尔尔类金属矣
电负性实质上就是元素的非金属性(非金属之德), 也就是元素原子对电子的控制能力.
从元素周期表来看, 对于主族元素与早期过渡元素(包括镧系元素但不包括阿系元素), 从左嚮右, 电负性递增:
感谢贝采li乌斯發明的化学符号, 让我快遬输入. 阿们.
χ(H)<χ(He)
χ(Li)<χ(Be)<χ(B)<χ(C)<χ(N)<χ(O)<χ(F)<χ(Ne)
χ(Na)<χ(Mg)<χ(Al)<χ(Si)<χ(P)<χ(S)<χ(Cl)<χ(Ar)
χ(K)<χ(Ca)<χ(Sc)<χ(Ti)<χ(V)<χ(Cr)<χ(Ga)<χ(Ge)<χ(As)<χ(Se)<χ(Br)<χ(Kr)
χ(Rb)<χ(Sr)<χ(Y)<χ(Zr)<χ(Nb)<χ(In)<χ(Sn)<χ(Sb)<χ(Te)<χ(I)<χ(Xe)
χ(Cs)<χ(Ba)<χ(La)<χ(Ce)<χ(Pr)<χ(Nd)<χ(Pm)<χ(Sm)<χ(Eu)<χ(Gd)<χ(Tb)<χ(Dy)<χ(Ho)<χ(Er)<χ(Tu)<χ(Yb)<χ(Lu)<χ(Hf)<χ(Ta)<χ(Tl)<χ(Pb)<χ(Bi)<χ(Po)<χ(At)<χ(Rn)
对于主族元素、早期过渡元素, 从上到下, 电负性一般减小(例外是次级周期律(这發生於刚刚走出过渡或者镧系的前几个元素, 即镥, 铪, 钽, 镓, 锗)、相对论效应(钫、镭、Ci、Mm)引起的)
χ(Li)>χ(Na)>χ(Ci)>χ(K)>χ(Rb)>χ(Fr)>χ(Cs)
χ(Be)>χ(Mg)>χ(Mm)>χ(Ca)>χ(Sr)>χ(Ra)>χ(Ba)
χ(Sc)>χ(Lu)>χ(Y)
χ(Ti)>χ(Hf)>χ(Zr)
χ(V)>χ(Ta)>χ(Nb)
χ(H)>χ(B)>χ(Ga)>χ(Al)>χ(In)>χ(Tl)
χ(C)>χ(Ge)>χ(Si)>χ(Sn)>χ(Pb)
χ(N)>χ(P)>χ(As)>χ(Sb)>χ(Bi)>χ(Mc)
χ(O)>χ(S)>χ(Se)>χ(Te)>χ(Po)>χ(Lv)
χ(F)>χ(Cl)>χ(Br)>χ(I)>χ(At)>χ(Ts)
χ(He)>χ(Ne)>χ(Ar)>χ(Kr)>χ(Xe)>χ(Rn)>χ(Og)
对于稀有气体的电负性, 如果考虑多个电子的效应, 也有人认为是
χ(Ne)>χ(He)>χ(Ar)>χ(Kr)>χ(Xe)>χ(Rn)>χ(Og)
对于主族元素与早期的过渡元素, 右上方的元素的电负性总是大于左下方:
χ(F)>χ(S)>χ(As)>χ(Se)>χ(Tl)
χ(O)>χ(P)>χ(Ge)>χ(In)>χ(Ta)>χ(Ba)
χ(N)>χ(Si)>χ(Ga)>χ(Nb)>χ(Hf)
χ(N)>χ(Si)>χ(Ga)>χ(Sr)>χ(Cs)
左上__右下对角线元素有着相近的电负性、化学性质(对角线规则), 并且导致金属与非金属界线的产生:
Be, Al, Ge, Sb, Po, Ts
B, Si, As, Te, At, Og
中後期的过渡元素的电负性变化较为複杂:
χ(Cr)<χ(Mo)<χ(W)
χ(Mn)<χ(Tc)<χ(Re)
χ(Fe)<χ(Os)<χ(Ru)
χ(Co)<χ(Rh)≈χ(Ir)
χ(Ni)<χ(Pd)<χ(Pt)
χ(Cu)<χ(Ag)<χ(Au)
χ(Zn)<χ(Cd)<χ(Hg)<χ(Cn)
Cn可能是稀有气体
对于电负性, 我又提出了自己的标度, 虽然可能缺陷太多, 不甚完善.
电离能取对数之後的图像

氮的电离能, 可清楚地见到2p、2s、1s

氧的电离能, 很好地反映了洪特规则

氖的电离能, 清楚地见到了2p、2s、1s

氩的电离能

钙的电离能

钴的电离能, 此时3d电子的能量开始降到与3p相近.

铜的电离能, 3d电子倾向于闭壳层

锌的电离能, 3d电子已经完全闭壳层, 与3s、3p融为一体, 成为[28]4s²(考试还是写[Ar]3d¹⁰4s²、1s²2s²2p⁶3s²3p⁶3d¹⁰4s², 除非窘公烷氮)

镓的电离能, 开始填充能量更高的4p能级

氪的电离能, 可清楚地看到4p、4s, 又看到第三层(M层)彻底填满. 虽然氪表面上是[Ar]3d¹⁰4s²4p⁶, 但称其为[28]4s²4p⁶更为准确(考试还是写[Ar]3d¹⁰4s²4p⁶、1s²2s²2p⁶3s²3p⁶3d¹⁰4s²4p⁶, 除非窘公烷氮).

锶的电离能

锆的电离能

钯的电离能, 由于相对论效应还很弱, 钻穿效应占据优势, 导致4d能级提前闭壳层并与4s能级、4p能级融为一体.

氙的电离能

镧的电离能

镨的电离能, 4f能级开始降到5d能级下边, 开取逼近5p能级.

镝的电离能, 4f能级降到与5s、5p相近

镥的电离能, 4f能级闭壳层

铪的电离能, 能量上开始越界5s、5p能级.

对于[68]构型的离子, 也就是1s²2s²2p⁶3s²3p⁶3d¹⁰4s²4p⁶4d¹⁰4f¹⁴5s²5p⁶, Yb²⁺先失去4f电子; Lu³⁺也可能是这样; Hf⁴⁺就说不清了; Ta⁵⁺应该先失去5p电子.
钽的电离能, 4f电子的能量低于5s、5p电子, Ta⁵⁺是[68]构型的离子中第一个先失去5p电子, 然後失去5s电子, 然後失去4f电子: 6, 2, 14, 10, 6, 2, 10, 6, 2, 6, 2, 2. 之後的元素亦如是.
氖的第一电子亲和能为吸收1电子伏特能量.
| 氖 | 电离能电子伏特 | 相对于氢 |
|---|---|---|
| I₁ | 22(2p) | 1ラ7 |
| I₂ | 41(2p) | 3ラ0 |
| I₃ | 63(2p, 半充满) | 4ラ8 |
| I₄ | 97(2p) | 7ラ2 |
| I₅ | 126(2p) | 9ラ3 |
| I₆ | 158(2p, 全空) | #ラ7 |
| I₇ | 207(2s) | 13ラ3 |
| I₈ | 239(2s, 全空) | 15ラ7 |
| I₉ | 1196(1s) | 73ラ# |
| I₁₀ | 1362(1s, 全空) | 84ラ2 |
差值
22, 19, 22
43, 29, 32
49, 32
957, 166
差值十二进制
2p
1ラ7, 1ラ5, 1ラ8
2ラ6, 2ラ1, 2ラ4
2s
3ラ8, 2ラ4
1s
5∗ラ4, 10ラ3
通过电离能可知, 原子的电子是分壳层分佈的, 且每个壳层都有亚壳层.
| 氩 | 电离能电子伏特 | 相对于氢 |
|---|---|---|
| I₁ | 16(3p) | 1ラ2 |
| I₂ | 28(3p) | 2ラ0 |
| I₃ | 41(3p, 半充满) | 3ラ0 |
| I₄ | 60(3p) | 4ラ5 |
| I₅ | 75(3p) | 5ラ6 |
| I₆ | 91(3p, 全空) | 6ラ9 |
| I₇ | 124(3s) | 9ラ2 |
| I₈ | 143(3s, 全空) | ∗ラ7 |
| I₉ | 423(2p) | 27ラ1 |
| I₁₀ | 480(2p) | 2#ラ3 |
| I₁₁ | 540(2p, 半充满) | 33ラ9 |
| I₁₂ | 619(2p) | 39ラ6 |
| I₁₃ | 685(2p) | 42ラ5 |
| I₁₄ | 755(2p, 全空) | 47ラ6 |
| I₁₅ | 855(2s) | 52ラ# |
| I₁₆ | 918(2s, 全空) | 57ラ6 |
| I₁₇ | 4121(1s) | 213ラ0 |
| I₁₈ | 4426(1s, 全空) | 231ラ6 |
差值
3p
1ラ2, 0ラ∗, 1ラ0
1ラ5, 1ラ1, 1ラ3
3s
2ラ5, 1ラ5
2p
17ラ6, 4ラ2, 4ラ6
5ラ9, 4ラ#, 5ラ1
2s
7ラ5, 4ラ7
1s
177ラ6, 1∗ラ6
对于主族元素, 从左到右, 元素的每一电离能呈增大趋势:
I₁(Li)<I₁(B)<I₁(Be)<I₁(C)<I₁(O)<I₁(N)<I₁(F)<I₁(Ne)
I₁(Na)<I₁(Al)<I₁(Mg)<I₁(Si)<I₁(S)<I₁(P)<I₁(Cl)<I₁(Ar)
铍、镁有异常高的第一电离能是因为其s亚壳层全充满的缘故;
氮、磷有异常高的第一电离能是因为其p亚壳层半充满的缘故;
事实上, 与铍、镁不同的是, 钙有一些过渡元素的性质, 比如钙可以形成八氨氯化钙CaCl₂(NH₃)₈等等配位化合物, 还有CaTaNO₂等等很稳定耐强酸的物质; 气态氟化钙分子有着水分子的折线构型, 最近科学家又合成了[Ca(CO)₈]; 钙的每一电子亲和能是放出能量的, 从Ca原子([Ar]4s²)到Ca⁻([Ar]3d¹4s²)放出2.37kJ·mol⁻¹能量.
在元素周期表中从上到下, 电离能一般变小:
I₁(Ne)>I₁(Ar)>I₁(Kr)>I₁(Xe)>I₁(Rn)>I₁(Og)
除了镧系元素、锕系元素、钯原子有例外之外, 从左到右, 原子半径变小; 从上到下, 原子半径变大.
比如
r(K)>r(Ca)>r(Sc)>r(Ti)>r(V)>r(Cr)>r(Mn)>r(Fe)>r(Co)>r(Ni)>r(Cu)>r(Zn)>r(Ga)>r(Ge)>r(As)>r(Se)>r(Br)>r(Kr)
r(Li)<r(Na)<r(K)<r(Rb)<r(Cs)
由于相对论效应, 有r(Na)<r(Ci)<r(K)<r(Rb)<r(Fr)<r(Cs)
从左到右, 阴离子半径变小, 且大于同周期的稀有气体原子, 稀有气体原子的半径大于下一周期的阳离子半径, 且下一周期的阳离子半径递减:
r(H⁻)>r(He)>r(Li⁺)>r(Be²⁺)>r(B³⁺)>r(C ⁺)
r(C ⁻)>r(N³⁻)>r(O²⁻)>r(F⁻)>r(Ne)>r(Na⁺)>r(Mg²⁺)>r(Al³⁺)>r(Si ⁺)
r(Si ⁻)>r(P³⁻)>r(S²⁻)>r(Cl⁻)>r(Ar)>r(K⁺)>r(Ca²⁺)>r(Sc³⁺)>r(Ti ⁺)
r(Se²⁻)>r(Br⁻)>r(Kr)>r(Rb⁺)>r(Sr²⁺)>r(Y³⁺)>r(Zr ⁺)>r(Nb⁵⁺)>r(Mo⁶⁺)
r(Se²⁻)>r(Br⁻)>r(Kr)>r(Rb⁺)>r(Sr²⁺)>r(Y³⁺)>r(Zr ⁺)>r(Nb⁵⁺)>r(Mo⁶⁺)
r(Te²⁻)>r(I⁻)>r(Xe)>r(Cs⁺)>r(Ba²⁺)>r(Ln³⁺)>r(Hf ⁺)>r(Ta⁵⁺)>r(W⁶⁺)
同族同价离子的半径, 随着周期增加而变大.
r(F⁻)<r(Cl⁻)<r(Br⁻)<r(I⁻)
r(Li⁺)<r(Na⁺)<r(K⁺)<r(Rb⁺)<r(Cs⁺)
r(Mg²⁺)<r(Ca²⁺)<r(Sr²⁺)<r(Ba²⁺)
离子半径随着化合价(氧化数)的升高而变小:
r(Fe)>r(Fe²⁺)>r(Fe³⁺)
r(Cu)>r(Cu⁺)>r(Cu²⁺)>r(Cu³⁺)
镧系元素的离子半径随质子数递增而变小
r(La³⁺)>r(Ce³⁺)>r(Pr³⁺)>r(Nd³⁺)>r(Pm³⁺)>r(Sm³⁺)>r(Eu³⁺)>r(Gd³⁺)>r(Tb³⁺)>r(Dy³⁺)>r(Ho³⁺)>r(Er³⁺)>r(Tu³⁺)>r(Yb³⁺)>r(Lu³⁺)
由原子单质的氧化性判断:
一般情况下, 单质氧化性越强, 对应元素非金属性越强.
由对应气态氢化物的稳定性判断: 气态氢化物越稳定, 非金属性越强.
由与氢气化合的难易程度判断: 化合越容易, 非金属性越强.
由最高价氧化物对应水化物的酸性来判断: 酸性越强, 非金属越强.
由置换反应判断: 强置弱. 〔若依据置换反应来说明元素的非金属性强弱,则非金属单质应做氧化剂,非金属单质做还原剂的置换反应不能作为比较非金属性强弱的依据〕
值得注意的是: 氟元素没有正价态, 故没有氟的含氧酸, 所以最高价氧化物对应水合物的酸性最强的是高氯酸, 而不是非金属性高于氯的氟元素. 本规律只适用于氟元素之外的非金属元素.
由对应阴离子的还原性判断: 还原性越强, 对应非金属性越弱.
在非金属元素的化合物中, 显负化合价的元素的非金属性较强.
按元素周期律, 同周期元素由左到右, 随核电荷数的增加, 非金属性增强;
同主族元素由上到下, 随核电荷数的增加, 非金属性减弱. 但也有例外: 铝, 镓; 钇, 镥.
| 名 | |
|---|---|
| 元素周期表 | ペリョ丌カ |
| 化学元素 | エレメㇴト゚ㇺ |
| 要素, 要点 | ヨソ |
| 金属单质 | カネ |
| 非金属单质 | ノㇴカネ |
| 金属元素 | メタㇻ̲リクㇲ |
| 非金属元素 | ノㇴメタㇻ̲リクㇲ |
| 非金属性 | ノㇴメタㇻ̲リクㇲトㇰ |
| 主族元素 | ツーチョㇰエレメㇴト゚ㇺ |
| 过渡元素 | 𰀪トエレメㇴト゚ㇺ |
| F区元素 | ヌイ𰀪トエレメㇴト゚ㇺ |
| 稀土 | ユㇳテㇻ̲ミト゚ㇺyttermidum |
| 镧系 | ラㇴサニト゚ㇺ |
| 锕系 | アㇰ丌ニト゚ㇺ |
| 钢 | ㇲ丌ーㇻ̲ |
| 合金 | アロイ |
原子序数超过172之时, 中性原子的1s能级的电子能量会低于1.02百万电子伏特, 这就导致库仑黑洞(Couromb black hole, クーロㇺクㇴネポルツㇷ゚)的产生, 也就是电子的逃逸遬度超过了光速, 从而使1s电子永远无法脱离其原子核, 亦导致裸原子核可氧化真空, 产生正电子(positron, ポシㇳロㇴ)与二体系统.
因此目前不清楚172号之後会發生何事.
有可能第172号元素之後的元素, 其裸原子核可以在氧化真空, 产生正负电子对, 其中电子进入库仑黑洞, 与原子核融合, 导致原子序数永远不会超过172.

在这张元素周期表中, 氢被排到硼上边而不是锂上边, 这是因为氢可以形成多中心分叉氢键, 比如颜料黄138中间的分叉氢键.

颜料黄138
| IA | IIA | IIIG | IVG | VG | VIG | VIIG | VIIIG | IXG | XG | XIG | XIIG | XIIIG | XIVG | XVG | XVIG | XVIIG | XVIIIG | IG | IIG | IIIC | IVC | VC | VIC | VIIC | VIIIC | IXC | XC | XIC | XIIC | XIIIC | XIVC | IC | IIC | IIIB | IVB | VB | VIB | VIIB | VIIIB | IXB | XB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 氢 | 氦 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 锂 | 铍 | 硼 | 碳 | 氮 | 氧 | 氟 | 氖 | ||||||||||||||||||||||||||||||||||||||||||
| 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 | ||||||||||||||||||||||||||||||||||||||||||
| 钾 | 钙 | 鍖 | 钛 | 钒 | 铬 | 锰 | 铁 | 钴 | 镍 | 铜 | 锌 | 镓 | 锗 | 砷 | 硒 | 溴 | 氪 | ||||||||||||||||||||||||||||||||
| 铷 | 锶 | 钇 | 锆 | 铌 | 钼 | 锝 | 钌 | 铑 | 钯 | 银 | 镉 | 铟 | 锡 | 锑 | 碲 | 碘 | 氙 | ||||||||||||||||||||||||||||||||
| 铯 | 钡 | 镧 | 铈 | 镨 | 钕 | 钷 | 钐 | 铕 | 钆 | 铽 | 镝 | 钬 | 铒 | 铥 | 镱 | 镥 | 铪 | 钽 | 钨 | 铼 | 锇 | 铱 | 铂 | 金 | 汞 | 铊 | 铅 | 铋 | 钋 | 砹 | 氡 | ||||||||||||||||||
| 钫 | 镭 | 锕 | 钍 | 镤 | 铀 | 镎 | 钚 | 镅 | 锔 | 锫 | 锎 | 锿 | 镄 | 钔 | 锘 | 铹 | 𬬻 | 𬭊 | 𬭳 | 𬭛 | 𬭶 | 鿏 | 𫟼 | 𬬭 | 鿔 | 鿭 | 𫓧 | 镆 | 𫟷 | 钿 | 鿫 | ||||||||||||||||||
| Uy | Ay | 123 | 124 | 125 | 鍏 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | 143 | 144 | 145 | 146 | 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 | 161 | 162 | 163 | 164 | ||||||
| 165 | 166 | 167 | 168 | 169 | 170 | 171 | 鏾 |
其中, 第165号元素~第168号元素进入第九周期.
鿔可被视为过渡元素中惟一的非金属元素, 请见数理化札记112
其中, 对于电子层, 有1K, 2L, 3M, 4N, 5O, 6P, 7Q, 8R之说, 也就是从k开始数latin字母.
| 周期 | 填充 |
|---|---|
| 1 | 1s |
| 2 | 2s, 2p |
| 3 | 3s, 3p |
| 4 | 4s, 3d, 4p |
| 5 | 5s, 4d, 5p |
| 6 | 6s, 4f, 5d, 6p |
| 7 | 7s, 5f, 6d, 7p |
| 8 | 8s, 5g, 6f, 7d, 8p |
| 周期 | s区 | 钞系 | 镧系锕系 | 过渡元素 | p区 |
|---|---|---|---|---|---|
| 1 | 1s | ||||
| 2 | 2s | 2p | |||
| 3 | 3s | 3p | |||
| 4 | 4s | 3d | 4p | ||
| 5 | 5s | 4d | 5p | ||
| 6 | 6s | 4f | 5d | 6p | |
| 7 | 7s | 5f | 6d | 7p | |
| 8 | 8s | 5g | 6f | 7d | 8p |

能级交错是因为这样有利于电子电荷同种电荷的均匀分散.
事实上, 由于相对论, 第七周期的电子排布就开始背离能级交错规则. 甚至第六周期就有这个迹象了, 比如铂是[Xe]4f¹⁴5d⁹6s¹, 这是因为相对论导致s能级能量下降, 更加稳定.
氢、氦填充第一电子层.
到了锂元素, 能量最小的轨道被填满了, 多出来的电子只能挤进下一层____第二电子层.
电子是从低能量轨域开始填充, 且满足泡利原理、hund规则.

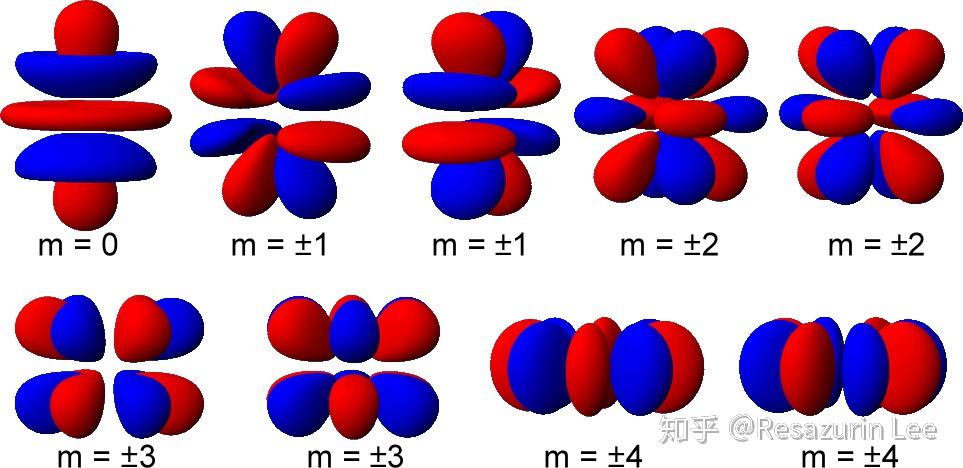
其中, (x²+y²)可以简化作r², 即
x²+y²=r²
这样的话, 3d轨道中间带环的就是(r²−2z²)
四量子数
主量子n
n=1, 第一电子层, K层;
n=2, 第二电子层, L层;
n=3, 第三电子层, M层;
n=4, 第四电子层, N层;
n=5, 第五电子层, O层;
n=6, 第六电子层, P层;
n=7, 第七电子层, Q层;
n=8, 第八电子层, R层;
n=9, 第九电子层, S层不是s能级
角量子数l
l=0, s轨道;
l=1, p轨道;
l=2, d轨道;
l=3, f轨道;
l=4, g轨道.
磁量子数
| 轨域 | 种类 |
|---|---|
| s | 1 |
| p | x, y, z |
| d |
|
同一电子层,
s轨域有1个, 最多可容纳2电子;
p轨域有3个, 最多可容纳6电子;
d轨域有5个, 最多可容纳10电子;
f轨域有7个, 最多可容纳14电子;
g轨域有9个, 最多可容纳18电子;
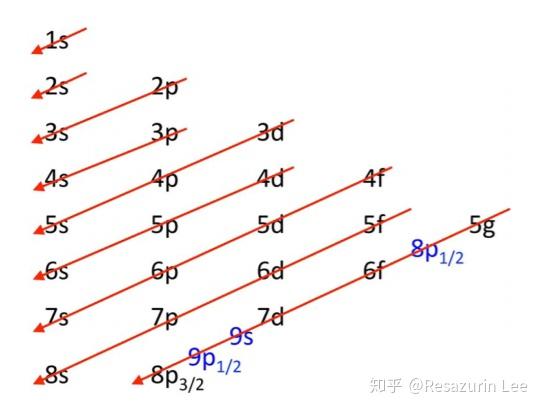
且考虑到同电荷排斥, 最外层会出现能级交错, 比如
对于第四周期, 先填充距离原子核更远但负电荷密度更小的4s能级, 之後才是3d能级. 到了铜与铜之後的元素, 能级交错结束, 3d能级遂的能量低于4s能级.
不考虑相对论效应和轨道宽阔形状因素第五周期过渡元素的话, 能级的填充顺序是
| 周期 | 能级 | 数目 |
|---|---|---|
| 1 | 1s | 2 |
| 2 | 2s,2p | 2+6=8 |
| 3 | 3s,3p | 2+6=8 |
| 4 | 4s,3d,4p | 2+10+6=18 |
| 5 | 5s,4d,5p | 2+10+6=18 |
| 6 | 6s,4f,5d,6p | 2+14+10+6=32 |
| 7 | 7s,5f,6d,7p | 2+14+10+6=32 |
| 8 | 8s,5g,6f,7d,8p | 2+18+14+10+6=50 |

有了能级交错原理, 继续按顺序填电子下去就可以解释为什么有主族、副族和镧系(lanthanidum)、锕系(actinidum)、钞系(zaunidum). 总之,给定角量子数为l, 就存在(2l+1)个简并轨道, 即每个电子层有最多有1个s轨道、3个p轨道、5个d轨道、7个f轨道、9个g轨道. 此之谓元素周期表.




家庭召会制服 | 生活用服 | 北中国国民通用衣服

早期的化学元素名称有很强的会意性质, 与汉字的象形性质很合, 很好地破除了封建迷信, 推动了科学知识在中国的普及.
| IA | IIA | IIIC | IVC | VC | VIC | VIIC | VIIIC | IXC | XC | XIC | XIIC | XIIIC | XIVC | IC | IIC | IIIB | IVB | VB | VIB | VIIB | VIIIB | IXB | XB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 氫 | 氜 | ||||||||||||||||||||||||||||||
| 鉐 | 鋊 | 碳 | 氮 | 氧 | 氟 | 氝 | |||||||||||||||||||||||||
 |
 |
 |
玻 | 硄 | 硫 | 氯 | □ | ||||||||||||||||||||||||
 |
鉰 | 鐟 | 釩 | 鉻 | 錳 | 鐵 | 錆 |  |
銅 |  |
□ | □ |  |
溴 | □ | ||||||||||||||||
| □ | 鎴 | 釔 | 鋯 | 鈮 | □ | 釕 | 錴 | □ | 銀 | 䤿 | 銦 | 錫 |  |
 |
□ | ||||||||||||||||
| 鏭 | □ | 鑭 | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | 鋨 |  |
鉑 | 金 | 汞 | 鉈 | 鉛 | 鈖 | □ | □ | □ | |
| □ | □ | □ | 釖 | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ |
| IA | IIA | IIIC | IVC | VC | VIC | VIIC | VIIIC | IXC | XC | XIC | XIIC | XIIIC | XIVC | IC | IIC | IIIB | IVB | VB | VIB | VIIB | VIIIB | IXB | XB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 氫 | 氜 | ||||||||||||||||||||||||||||||
| 鉐 | 鋊 | 碳 | 氮 | 氧 | 氟 | 氝 | |||||||||||||||||||||||||
 |
 |
 |
玻 | 硄 | 硫 | 氯 | 气ア | ||||||||||||||||||||||||
 |
鍖 | 鍉 | 鋺 | 鉻 | 鏝 | 鐵 | 錆 |  |
銅 |  |
鉫 | 鐱 | 鉪 | 溴 | 气キ | ||||||||||||||||
| 金ル | 鎴 | 釪 | 鑇 | 鈮 | 鍀 | 釕 | 錴 | 金パ | 銀 | 䤿 | 銦 | 錫 |  |
气世 | |||||||||||||||||
| 䤤 | 鋇 | 鑭 | 鐄 |  |
䤲 | 钐 | 銪 | 金伽 | 金テ | 釶 | 鍭 | 鈪 | 鋀 | 金ユ | 镥 | 金ハ̅ | 鉭 | 鋙 | 𨰣 | 鏂 |  |
鉑 | 金 | 汞 | 鉈 | 鉛 | 鈖 | 鉥 |  |
||
| 鍅 | 金ラ | 錒 | 鍮 | 鏤 | 錗 | 鈈 | 鎇 | 鋦 | 鉳 | 鉲 | 鑀 | 鐨 | 钔 | 鎒 | 铹 | □ | □ | □ | □ | □ | 鋂 | 鐽 | 錀 | 鎶 | 鉨 | 鈇 | 鏌 | 鉝 | 鈿 | 鿫 | |